2024年ノーベル生理学・医学賞「マイクロRNAと転写後遺伝子制御における役割の発見」とは?
2024年ノーベル生理学・医学賞「マイクロRNAと転写後遺伝子制御における役割の発見」とは?

2024/12/18

2024年ノーベル生理学・医学賞「マイクロRNAと転写後遺伝子制御における役割の発見」
とは?
科学の目でみる、
社会が注目する本当の理由

マイクロRNAとは?
2024年のノーベル生理学・医学賞を受賞したビクター・アンブロス博士とゲイリー・ラブカン博士が発見したのがマイクロRNAです。マイクロRNAは遺伝子制御を担う分子として、現在ヒトには2,000種類以上あることがわかっており、マイクロRNAの異常は疾患と関連することも指摘されています。マイクロRNAに注目した創薬研究もあり、医療応用も期待されています。
2024年のノーベル生理学・医学賞は、「マイクロRNAと転写後遺伝子制御における役割の発見」に対して、アンブロス博士とラブカン博士の2人に授与されました。マイクロRNAの発見以前は、DNAからメッセンジャーRNA(mRNA)への合成が遺伝子制御の主な仕組みと考えられていましたが、2人の発見によってmRNAからタンパク質への合成を調節する仕組みもあることが明らかになりました。マイクロRNAの機能や働き、今後のマイクロRNAに関する研究の動向について、細胞分子工学研究部門 分子機能応用研究グループの佐野将之主任研究員に聞きました。
遺伝子は「使うかどうか」の制御を受けている
マイクロRNAとは、ヒトを含む多くの生物で遺伝子制御を行っている分子のことです。まずは、遺伝子制御とはどういうものかについて解説します。
ヒトには約20,000種類の遺伝子がありますが、すべての細胞ですべての遺伝子が働いているわけではありません。ある遺伝子は神経細胞には必要ですが、皮膚の細胞では不要というものがあります。遺伝子は「あるかどうか」だけでなく、「使われるかどうか」もまた重要です。
遺伝子は、細胞の中ではDNAという物質に遺伝情報として組み込まれています。DNAからメッセンジャーRNA(mRNA)に転写され、mRNAからタンパク質が合成(翻訳)されます。このタンパク質が体内でさまざまな機能を発揮することで、生命活動が維持されます。
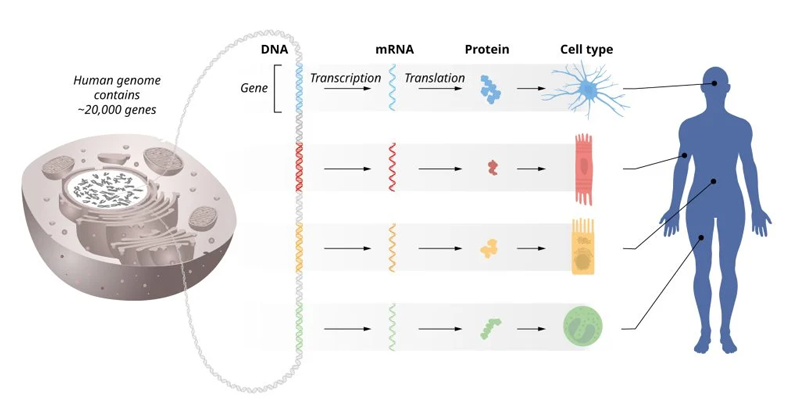 組織によってどの遺伝子が発現するかが違う(ノーベル財団プレスリリースより引用)
組織によってどの遺伝子が発現するかが違う(ノーベル財団プレスリリースより引用)
DNAからmRNAに転写され、mRNAからタンパク質に翻訳されることを「遺伝子発現」といいます。この一連の過程の中では、発現量を調節するさまざまな仕組みがあります。その仕組みによって、「遺伝子が使われるかどうか」という遺伝子制御を行っています(産総研マガジン「エピジェネティクスとは?」)。
遺伝子制御のうち、代表的な仕組みはDNAからmRNAへの転写制御です。転写因子や転写制御因子とよばれるタンパク質がDNAに結合して、mRNAへの転写を制御していることが1960年代に明らかになりました。その後、数千種類の転写因子が見つかり、遺伝子制御のメインの仕組みは解明されたと考えられていました。
mRNAに結合してタンパク質翻訳を阻害するマイクロRNA
今回、ノーベル生理学・医学賞のテーマとなったマイクロRNAは、mRNAに結合してタンパク質への翻訳を抑制するものです。
一般的なmRNAは塩基というものが数百から数千つながっていますが、マイクロRNAはわずか20〜25塩基程度からなる非常に短いRNAです。マイクロRNAもDNAから転写されて作られるのですが、マイクロRNAからタンパク質に翻訳されることはありません。マイクロRNAがmRNAに結合することでmRNAが不安定化したり、タンパク質への翻訳が阻害されたりするという、遺伝子制御に関わっています。
現在では、1種類のマイクロRNAが複数のmRNAに結合すること、反対に1つのmRNAに複数種類のマイクロRNAが結合できることがわかっています。ヒトには2,000種類以上のマイクロRNAがあり、mRNAの60 %以上がマイクロRNAによる制御を受けているとされています。マイクロRNAは、遺伝子発現の微調整をしていると表現できます。
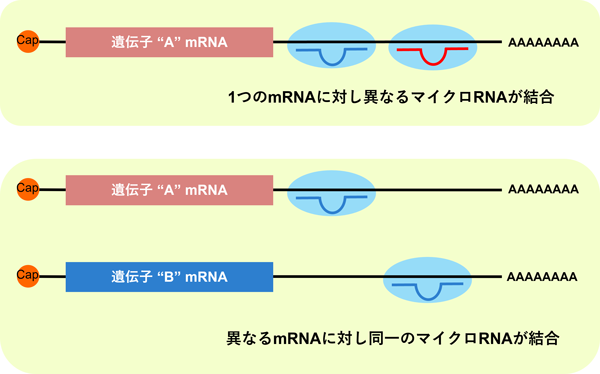 遺伝子発現を微調整するマイクロRNA
遺伝子発現を微調整するマイクロRNA
ところで、2006年のノーベル生理学・医学賞の受賞テーマはRNA干渉でした。RNA干渉とマイクロRNAは、mRNAからタンパク質への翻訳を抑制するという点では共通していて、仕組み自体もかなり似ています。それもそのはず、RNA干渉は自然界にあるマイクロRNAと共通の作用機構を利用しており、人工的に2本鎖RNAを外から導入して、mRNAを切断します。一般に、RNA干渉はマイクロRNAよりも強い作用があり、人間が開発したテクノロジーとして、幅広い生命科学分野で利用されています。
ノーベル賞受賞のポイント
短すぎるRNAが見つかった
マイクロRNAと、その機能を初めて発見したのが、今回ノーベル生理学・医学賞を受賞したアンブロス博士とラブカン博士です。2人は、線虫という生物を使って、受精卵からの体づくり(発生)にどのような遺伝子が関わっているのかを研究していました。
線虫とは体長約1ミリメートルの生物で、C. elegans(シーエレガンス)という種類の線虫は世界中の研究室で実験動物として使われています。細胞は全部で約1,000個しかなく、どの細胞が最終的にどの組織になるかがすべてわかっていて、透明で観察しやすく、発生の研究では優れた実験動物です。
アンブロス博士とラブカン博士が注目していたのは、発生の過程に異常があり、正常な個体とならないlin-4とlin-14という遺伝子に変異が起こった線虫でした。当初、アンブロス博士とラブカン博士は同じ研究室に所属していて、それぞれ独立して自身の研究室をもつようになってからも情報交換を続けていたようです。
アンブロス博士は、lin-4遺伝子がlin-14遺伝子の発現を抑制していることを突き止め、その詳しい仕組みを知るためにlin-4遺伝子を調べることにしました。ところが、lin-4遺伝子から作られるRNAはわずか22塩基と短く、タンパク質を作るはずがありません。そこでアンブロス博士は、この短いRNA自体がlin-14遺伝子を制御できるのではないかと考えました。
一方、ラブカン博士も独自にlin-14遺伝子の塩基配列を調べていました。そして、アンブロス博士が知るlin-4遺伝子の塩基配列と、ラブカン博士が知るlin-14遺伝子の塩基配列を比べたところ、lin-14 mRNAの一部に短いlin-4 RNAが結合できることを発見しました。その後、lin-14 mRNAからタンパク質に翻訳されるのをlin-4 RNAが抑制することを実験で確かめ、1993年に報告されました。
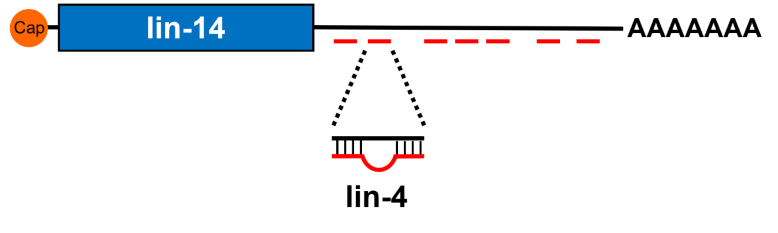 lin-14 mRNAの7カ所にlin-4 マイクロRNAが結合できる配列を発見
lin-14 mRNAの7カ所にlin-4 マイクロRNAが結合できる配列を発見
マイクロRNAがヒトにもあった
発表当初、2人の研究はそれほど大きく注目されませんでした。興味深い報告ではあるものの、線虫独自の現象と考えられていたからです。
ところが2000年、ラブカン博士らはlin-4と同じように短いRNAで遺伝子発現抑制機能があるlet-7を発見します。let-7は線虫だけでなく、昆虫、魚類、そしてヒトにも存在することがわかり、マイクロRNAによる遺伝子制御は幅広い生物で共通の現象と考えられるようになりました。ちなみに、マイクロRNAという言葉は2001年から使われるようになりました。
このことを機にマイクロRNAの研究が大きく進み、現在では多くの生物で遺伝子発現の制御を担う重要な分子であると認識されています。
今後のマイクロRNA研究
マイクロRNAを含めて、タンパク質に翻訳されないRNAのことを「ノンコーディングRNA」といいます。マイクロRNAの発見は、ノンコーディングRNA研究が広がるきっかけになったと思います。
実は、ノンコーディングRNAも生物の高度な機能に必要だと考えられています。単細胞生物の大腸菌では、全DNA領域のうちタンパク質を作る部分は約88 %を占め、線虫では約24 %、ヒトではわずか2 %程度です。ところが、ノンコーディングRNAを作る部分は、大腸菌に比べ線虫やヒトではかなり多く、複雑な生物ほどノンコーディングRNAが多様化する傾向にあります。
実際、マイクロRNAは幹細胞の増殖や、他の種類の細胞に変化する分化という現象に関わることがわかっています。組織ごとに存在するマイクロRNAの種類が違うこともわかっており、マイクロRNAが組織の特徴を決定づける要因であるともいえます。
裏を返せば、マイクロRNAの異常は多くの疾患と関連します。糖尿病などの代謝疾患や、アルツハイマー病やパーキンソン病などの神経変性疾患では、マイクロRNAの存在量が変化することがわかっています。
マイクロRNAとの関連が注目されている疾患が、がんです。がん細胞が異常増殖するとき、浸潤や転移をするとき、腫瘍が血管を新しく作らせるときなどでは、さまざまなマイクロRNAの量が変化します。この変化に注目して、がんの進行を調べるバイオマーカーとしてマイクロRNAを活用する研究があります(産総研マガジン「バイオマーカーとは?」)。また、がん細胞で減少したマイクロRNAを外部から補充したり、増えすぎたマイクロRNAを機能阻害したりできれば、がんを治療できるかもしれません。こうしたコンセプトのもと、国内外で研究開発や臨床試験が行われています。
「線虫の発生に関わる遺伝子は何か?」という疑問から始まったアンブロス博士とラブカン博士の研究が、多くの生物で共通する遺伝子発現制御の仕組みの発見につながり、さらにはさまざまな疾患の治療に応用できる可能性を秘めているのがマイクロRNAなのです。
産総研でも細胞内のマイクロRNAを検出する技術開発*1や、非翻訳RNAの発現を予測するAIの開発(2022/11/22プレスリリース)などに取り組んでいます。私たちも、今後さらに進展するであろうRNA、マイクロRNAの研究に寄与していきたいと考えています。
*1: Masayuki Sano, Kana Morishita, Satoshi Oikawa, Takayuki Akimoto, Kimio Sumaru, Yoshio Kato, Live-cell imaging of microRNA expression with post-transcriptional feedback control, Molecular Therapy - Nucleic Acids, Volume 26, 2021, Pages 547-556, ISSN 2162-2531,
https://doi.org/10.1016/j.omtn.2021.08.018. [参照元へ戻る]