国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)生物プロセス研究部門【研究部門長 田村 具博】生物共生進化機構研究グループ 深津 武馬 首席研究員(兼)研究グループ長、松浦 優 元産総研技術研修員(現 北海道大学 日本学術振興会特別研究員)、環境生物機能開発研究グループ 菊池 義智 主任研究員は、国立大学法人 北海道大学【総長 山口 佳三】大学院地球環境科学研究院 三浦 徹 准教授と共同で、ヒメナガカメムシという昆虫において共生細菌を保有する菌細胞の発生過程と形成機構を解析した。その結果、いくつかのホメオティック遺伝子という形態形成に関わる遺伝子の中で、特にウルトラバイソラックス遺伝子が胚発生の過程で新しい発現部位を獲得することにより、菌細胞ができることを明らかにした。
菌細胞という微生物との共生に特殊化した細胞の由来は、長年にわたり進化発生学における謎であったが、今回の成果は、その形成に関わる重要な分子機構を解明したものであり、細胞が分化する機構、共生の分子レベルでの仕組み、細菌感染からの防御などに貢献が期待される。
なお、この成果は2015年7月14日午前3時(日本時間)に米国の学術誌「Proceedings of the National Academy of Sciences USA」(米国科学アカデミー紀要)にオンライン掲載される。
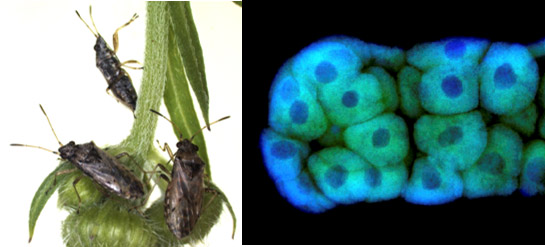 |
ヒメナガカメムシ(左)と菌細胞が多数集合した共生器官の菌細胞塊(右)
緑色は共生細菌の局在を、青色はDNAを示す。 |
既知の生物種の過半数は昆虫類であり、生物多様性の中核を担う動物群として、その高度で多彩な生物機能の開発や利用が期待されている。なかでも昆虫類に広く見られる性質として、微生物を体内や細胞内に恒常的に保有し、共生関係を構築する能力がある。農業害虫や衛生害虫を含む多くの昆虫類が細菌と細胞内共生関係にあり、必須栄養素の供給など生存に必要な機能を獲得している。これら細胞内共生細菌の多くは、宿主である昆虫の体内で、共生のために特殊化した細胞である「菌細胞」に局在して保持され、重要な生物機能を果たし、母親の体内で次世代の卵や初期胚に伝達される。
このように菌細胞は、昆虫と細菌の高度な共生関係の基盤となる重要な細胞であり、害虫防除などの観点からも関心がもたれるが、その由来や起源は長年の謎であり、形成機構も不明であった。
産総研では、昆虫の体内に共生する細菌がもつ重要な生物機能の解明(2004年3月26日、2007年6月13日、2012年4月24日、2014年9月26日 産総研プレス発表)、昆虫と共生細菌の高度な生物間相互作用の理解(2002年10月29日、2013年6月11日、2013年6月21日、2014年7月1日 産総研プレス発表)などに取り組んできた。
特に昆虫類の菌細胞内の共生細菌については、「トコジラミに必須栄養素を供給する細胞内共生細菌ボルバキアの発見」(2009年12月22日 産総研プレス発表)、「生存に必須な共生細菌が子孫へ伝達される瞬間をとらえた!」(2012年5月28日 産総研主な研究成果)などの研究成果がある。
今回は、従来ほとんど研究されていなかったが、菌細胞をもち、RNA干渉法によって遺伝子機能を解析できるヒメナガカメムシという昆虫について、菌細胞形成の謎の解明に取り組んだ。
なお、本研究成果の大部分は、筑波大学大学院生(兼 産総研技術研修員、日本学術振興会特別研究員)であった松浦 優が深津 武馬の指導のもとで博士課程の研究課題として遂行したものである。また、本研究成果の一部は、文部科学省 科学研究費補助金の支援を受けておこなった。
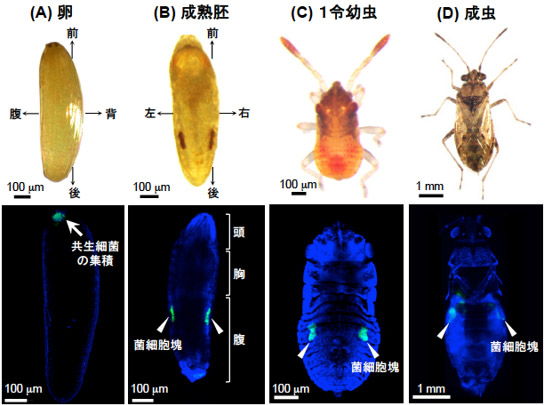
カメムシ類は一般に腸内に共生細菌をもつが、ヒメナガカメムシは例外的に菌細胞内にシュナイデリア(Schneideria)という共生細菌をもつことを見出していた。ヒメナガカメムシ体内での共生細菌の分布を調べたところ、産卵直後には卵前端に集積していたが(図1A)、成熟胚ではすでに腹部両側にある一対の菌細胞塊に局在しており(図1B)、幼虫から成虫に成長しても同様の局在であった(図1C、D)。
 |
|
図1 ヒメナガカメムシ体内の共生細菌と菌細胞塊の分布 |
|
(A) 卵。(B) 成熟胚。(C) 1令幼虫。(D) 成虫。上段は明視野像、下段は共焦点蛍光顕微鏡像。緑色は共生細菌、青色は核DNAを示す。 |
 |
|
図2 ヒメナガカメムシの胚発生過程での共生細菌と菌細胞塊の分布 |
|
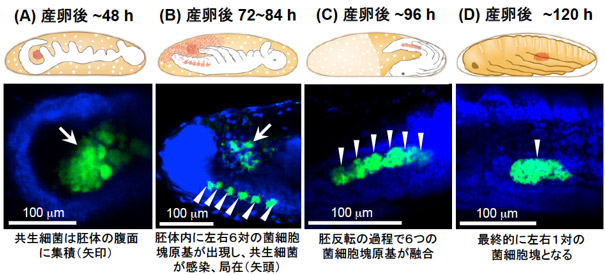
(A) 産卵後〜48時間。(B) 産卵後72〜84時間。(C) 産卵後〜96時間。(D) 産卵後〜120時間。上段は胚形態の模式図。赤色で共生細菌の分布を図示する。下段は共焦点蛍光顕微鏡像。緑色は共生細菌、青色は核DNAを示す。 |
そこで胚発生過程での共生細菌の分布をより詳細に調べたところ、産卵後48時間頃に共生細菌が胚体外の腹面に集積し(図2A)、産卵後72〜84時間後には胚体内に左右6対の菌細胞塊原基が出現し、共生細菌が移動、感染、局在化した(図2B)。その後、産卵後96時間頃には左右の6つの菌細胞塊原基がそれぞれ融合し(図2C)、最終的に左右1対の菌細胞塊が形成された(図2D)。
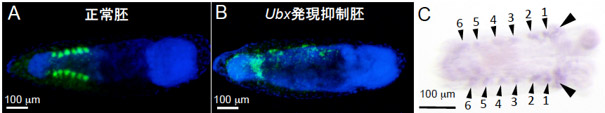
これまでにアブラムシの菌細胞にホメオティック遺伝子産物が局在するという報告があったが、アブラムシでは遺伝子の機能解析が困難なため、その後の研究は進んでいなかった。一方、ヒメナガカメムシではRNA干渉法によって遺伝子機能を解析できる。そこで、胚発生過程での各種ホメオティック遺伝子の発現を同法により抑制してみたところ、ウルトラバイソラックス遺伝子の発現を抑制すると菌細胞が形成されなくなり、行き場を失った共生細菌が散在することが観察された(図3A、B)。さらにin situ ハイブリダイゼーション法によりヒメナガカメムシ正常胚のウルトラバイソラックス遺伝子の発現局在を調べたところ、左右6対の菌細胞塊原基に完全に一致した(図3C)。ウルトラバイソラックス遺伝子はショウジョウバエでは後胸と第1腹節の形態形成に関与するが、ヒメナガカメムシではウルトラバイソラックス遺伝子の新たな発現パターンが獲得され、胚発生時に菌細胞形成に働いていると考えられる。
 |
|
図3 ヒメナガカメムシ胚でのウルトラバイソラックス遺伝子の発現と抑制の影響 |
|
(A) 正常胚。腹部に6対の菌細胞塊原基が形成され、共生細菌が局在している。(B)ウルトラバイソラックス遺伝子の発現を抑制した胚。菌細胞塊原基が形成されず、共生細菌が散在している。(A)-(B)で緑色は共生細菌、青色は核DNAを示す。(C)正常胚でのウルトラバイソラックス遺伝子の発現局在。菌細胞塊原基と一致した6対の発現領域(小矢頭)が検出された。胚前方の発現(大矢頭)は、ウルトラバイソラックス遺伝子本来の発現領域である後胸と腹節前端での発現。(A)-(C)はいずれも産卵後約84時間の胚。 |
その他のホメオティック遺伝子にも菌細胞形成に影響を与えるものがあった。アンテナペディア遺伝子はショウジョウバエでは脚形成を制御するが、RNA干渉法によってヒメナガカメムシ胚での発現を抑制すると、菌細胞塊の位置が胚の前方に移動し、中には脚の中に菌細胞を形成する個体も出現した。アブドミナルA遺伝子はショウジョウバエでは第2〜8腹節の形成を制御するが、ヒメナガカメムシ胚での発現を抑制すると、菌細胞塊の融合が不完全になり、いくつかの細胞塊に分断された。しかしこれらの遺伝子の発現パターンは左右6対の菌細胞原基とは一致しなかった。
結論として、ショウジョウバエやその他の動物で、発生や形態形成にきわめて重要な役割を果たすホメオティック遺伝子群が、ヒメナガカメムシではそれら本来の機能に加えて、菌細胞の形成にも転用されていることが明らかになった。本研究により、進化発生学における長年の謎であった、昆虫と細菌の高度な共生関係を支える菌細胞の形成機構の理解が大きく進展した。
今後は、特にヒメナガカメムシにおけるウルトラバイソラックス遺伝子の発現制御機構について研究を進め、どのような仕組みでヒメナガカメムシ胚に特有の発現パターンが獲得されたのかを追求する予定である。またヒメナガカメムシ胚の菌細胞塊原基領域を単離して、次世代DNAシークエンサーにより網羅的発現遺伝子解析をおこなって、菌細胞分化に関わる遺伝子ネットワークの全貌解明を推進していく。もし、ヒメナガカメムシの胚発生過程において共生細菌が菌細胞塊原基を認識して特異的に感染するシグナル分子が同定できれば、昆虫の共生細菌だけではなく病原細菌なども含めた感染制御技術の開発につながる可能性もあり、そのような観点からも研究を進める。