独立行政法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)生物プロセス研究部門【研究部門長 鎌形 洋一】深津 武馬 首席研究員(兼)生物共生進化機構研究グループ長、古賀 隆一 主任研究員らと、沖縄科学技術大学院大学【学長 ジョナサン・ドーファン】佐藤 矩行 教授らは、米国モンタナ大学、放送大学などと共同で、農業害虫として知られるコナカイガラムシでは、共生器官の細胞内に極度にゲノムの縮小した2種の細菌が入れ子状になって共生し、さらに過去に多様な細菌から昆虫ゲノムに水平転移した20種以上の遺伝子が共生器官で発現し、それらがモザイク状かつ相互補完的にアミノ酸合成、ビタミン合成、細胞壁合成などの共生関係に必須な代謝経路を構築していることを発見した。これは、従来の常識を超えた複雑な共生システムである。
この研究成果は2013年6月21日(日本時間)に米国の学術誌「Cell」に掲載される。(DOI:10.1016/j.cell.2013.05.040)
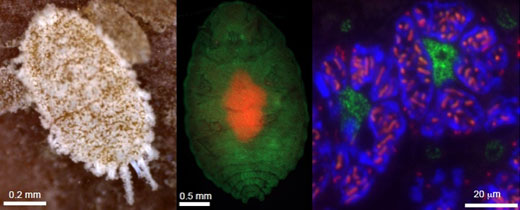 |
|
(左)ミカンコナカイガラムシ(中)その腹部には共生器官である菌細胞塊(赤色)が存在する(右)個々の菌細胞の細胞質中に不定形のβ共生細菌(青色)が、さらにその内部に入れ子状にγ共生細菌(赤色)が入っており、宿主の細胞核(緑色)には多様な細菌由来の水平転移遺伝子が存在する。 |
地球上に存在する多種多様な生物の最も根源的な分類は、原核生物と真核生物の区分である。単純な原核細胞からより複雑な真核細胞が生じた過程の解明は、生命の多様性および進化を解明するうえで極めて重要である。真核生物の起源については、細胞内共生説が基本的な定説となっている。昆虫、植物、菌類、原生生物などで多種多様な細胞内共生関係がみられるが、すべて真核細胞が原核細胞、あるいは真核細胞を取り込んだ内部共生である。真核細胞の進化過程の理解に関係する、原核細胞が原核細胞を取り込む形の細胞内共生は、長年、実例が知られていなかった。
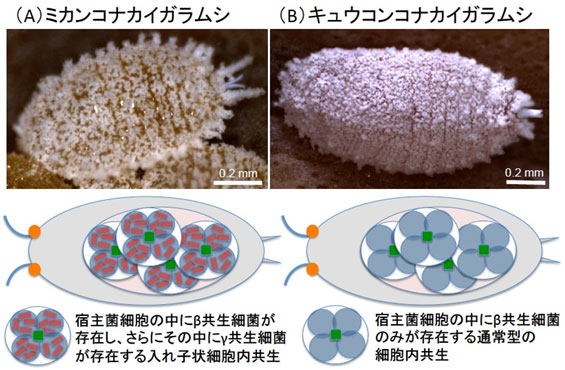
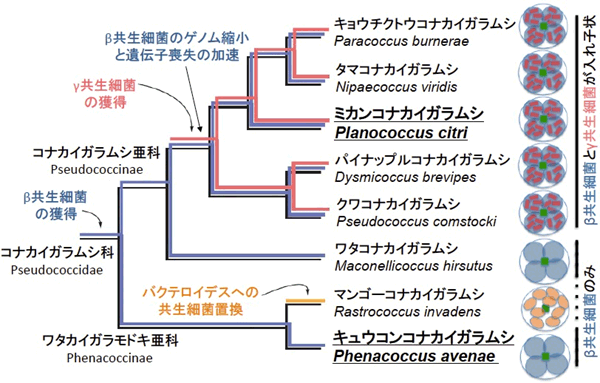
しかし近年、ミカンコナカイガラムシという害虫の体内に菌細胞塊という共生器官が存在し、その細胞の中に共生細菌トレンブレイヤ(β共生細菌)が存在し、さらにそのβ共生細菌の内部に共生細菌モラネラ(γ共生細菌)が存在するという、入れ子状の共生システムが発見された。その後、ミカンコナカイガラムシのβ共生細菌とγ共生細菌の全ゲノム塩基配列が決定され、さらに多様なコナカイガラムシ類の比較研究により、コナカイガラムシ亜科(Pseudococcinae)のミカンコナカイガラムシなどでは菌細胞中にβ共生細菌とγ共生細菌が入れ子状に共生しているのに対して、ワタカイガラモドキ亜科(Phenacoccinae)のキュウコンコナカイガラムシなどでは菌細胞中にβ共生細菌しか存在せず、γ共生細菌を獲得する前の祖先的な内部共生システムである可能性が示唆された(図1、2)。
 |
|
図1 ミカンコナカイガラムシ(A)とキュウコンコナカイガラムシ(B)の内部共生システムの構成の模式図 |
 |
|
図2 コナカイガラムシ類の内部共生システムの多様性と推定される進化過程 |
産総研を代表とする日本の研究グループは、モンタナ大学を代表とする米国の研究グループと共同で、ミカンコナカイガラムシ(図1A)の菌細胞の網羅的遺伝子発現解析と概要ゲノム配列決定、そしてキュウコンコナカイガラムシ(図1B)のβ共生細菌の全ゲノム塩基配列決定を行い、コナカイガラムシ類における原核細胞と原核細胞で構成される内部共生システムの進化過程を、沖縄科学技術大学院大学の研究チームの協力を得てゲノムレベルで解明する研究プロジェクトを開始した。
なお、本研究成果の一部は、独立行政法人 農業・食品産業技術総合研究機構 生物系特定産業技術研究支援センターおよび文部科学省 科学研究費補助金の支援を受けて行った。
キュウコンコナカイガラムシのβ共生細菌のゲノムを決定したところ、175個のタンパク質をコードする遺伝子を保有していた。ミカンコナカイガラムシのβ共生細菌は121個のタンパク質をコードする遺伝子を保有しているため、ミカンコナカイガラムシの祖先がγ共生細菌を獲得してから現在に至るまでに、β共生細菌のゲノムから少なくとも50個以上の遺伝子が失われたと推定された(図2)。
キュウコンコナカイガラムシのβ共生細菌は、大部分の翻訳関連の遺伝子群を保有していた(図3B青)が、ミカンコナカイガラムシのβ共生細菌ではほとんどの翻訳関連遺伝子群が失われ、γ共生細菌の遺伝子群(図3A橙)がそれらの代謝経路を相補する形になっていた。すなわち、β共生細菌はγ共生細菌の獲得に伴って翻訳関連遺伝子群を失ったと推定される。
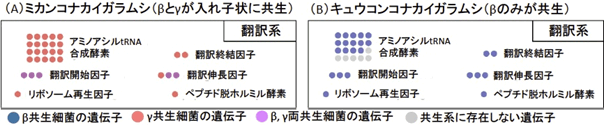 |
図3 ミカンコナカイガラムシ(A)およびキュウコンコナカイガラムシ(B)の内部共生 システムにおける翻訳関連遺伝子群の構成
●の色は遺伝子の由来または有無を示す(凡例を参照)。●の数はそのカテゴリに属する遺伝子の数を表す。例えばアミノアシルtRNA合成酵素をコードする遺伝子は、タンパク質を構成する20種類のアミノ酸に対応した20種類がある。 |
カイガラムシ類は一生を通じてタンパク質をほとんど含まない植物の汁液のみを餌とするため、共生細菌からの10種類の必須アミノ酸の供給が必要である。キュウコンコナカイガラムシのβ共生細菌では、合成系遺伝子が全て揃っている必須アミノ酸はトリプトファンとアルギニンの2種のみで、他の8種の必須アミノ酸の合成経路が不完全となっていた(図4B)。ミカンコナカイガラムシでも同様に、合成系遺伝子が全て揃っている必須アミノ酸はトリプトファンとアルギニンの2種のみであったが、β共生細菌の遺伝子(図4A橙)とγ共生細菌の遺伝子(図4A青)がモザイク状に組み合わさって合成系が完成していた。他の8種の必須アミノ酸についても同様に、β共生細菌の遺伝子とγ共生細菌の遺伝子がモザイク状に組み合わさって不完全な合成経路を構築していた(図4A)。
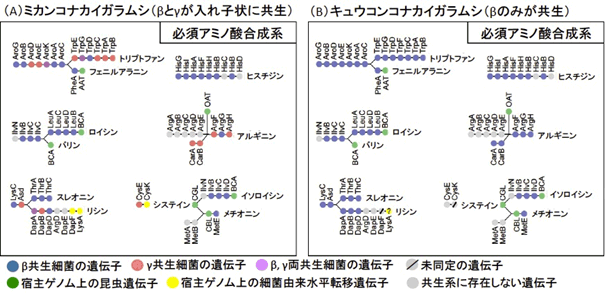 |
図4 ミカンコナカイガラムシ(A)およびキュウコンコナカイガラムシ(B)の内部共生システムにおける必須アミノ酸合成系遺伝子群の構成
●はそれぞれアミノ酸合成系の遺伝子(上/下に示すアルファベットは遺伝子名)で、アミノ酸合成経路の順に並べて示す。●の色は遺伝子の由来または有無を示す(凡例を参照)。 |
共生細菌の必須アミノ酸合成経路で欠けている遺伝子はどうなっているのかを明らかにするために、ミカンコナカイガラムシの共生器官と全身で発現している宿主昆虫遺伝子を網羅的に解析した。その結果、多くの欠失遺伝子については、似た機能をもつ宿主昆虫の遺伝子が共生器官で発現して、相補されているらしいことが判明した(図4A緑)。ところが、3種の欠失遺伝子については、宿主昆虫の遺伝子ではなく、β共生細菌やγ共生細菌とは異なる細菌に由来する遺伝子に相補されていることがわかった(図4A黄)。
共生細菌が供給する栄養素として重要なビタミンBの合成系遺伝子群についても、同様の結果が得られた(図5)。ミカンコナカイガラムシのリボフラビン(ビタミンB2)合成経路の4種の遺伝子のうち、2種はγ共生細菌の遺伝子(図5Aリボフラビン橙)であったが、残りの2種は、β共生細菌やγ共生細菌とは異なる細菌に由来する遺伝子(図5Aリボフラビン黄)であった。ビオチン(ビタミンB7)についても、γ共生細菌の6遺伝子(図5Aビオチン橙)に加えて、最終段階の3遺伝子(図5Aビオチン黄)が他の細菌由来であった。
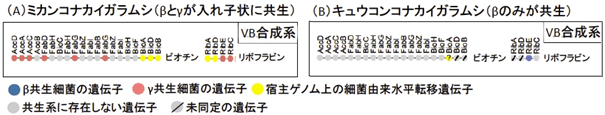 |
図5 ミカンコナカイガラムシ(A)およびキュウコンコナカイガラムシ(B)の内部共生システムにおけるビタミンB(VB)合成系遺伝子群の構成
●はそれぞれVB合成系の遺伝子(上に示すアルファベットは遺伝子名)で、VB合成経路の上に順番に並べて示す。●の色は遺伝子の由来を示す(凡例を参照)。 |
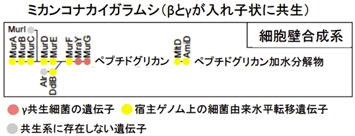
細胞壁合成系の遺伝子群ではさらに極端な結果となった(図6)。ミカンコナカイガラムシの共生器官において、細菌細胞壁の主要構成成分である
ペプチドグリカンの合成系遺伝子群は2個だけがγ共生細菌の遺伝子(図6橙)で、残りはβ共生細菌やγ共生細菌とは異なる細菌に由来する遺伝子(図6黄)であった。
 |
|
図6 ミカンコナカイガラムシの内部共生システムにおける細胞壁合成系遺伝子群の構成
●はそれぞれ細胞壁合成系の遺伝子(上/下に示すアルファベットは遺伝子名)で、ペプチドグリカン合成経路の順に並べて示す。●の色は遺伝子の由来または有無を示す(凡例を参照)。 |
ミカンコナカイガラムシのゲノム解析から、これらβ共生細菌やγ共生細菌とは異なる細菌に由来する遺伝子は、すべて宿主昆虫の核ゲノム上に存在することが確認された。つまりコナカイガラムシは、その細胞内に2種類の共生細菌を入れ子状に保有するだけでなく、多種多様な細菌からさまざまな代謝系遺伝子を水平転移により獲得していた。これらの共生細菌の遺伝子と水平転移した遺伝子を組み合わせて機能的な代謝経路を構築することで、コナカイガラムシが生存可能になっているという、従来の常識を超えた複雑な共生システムであることが判明した。
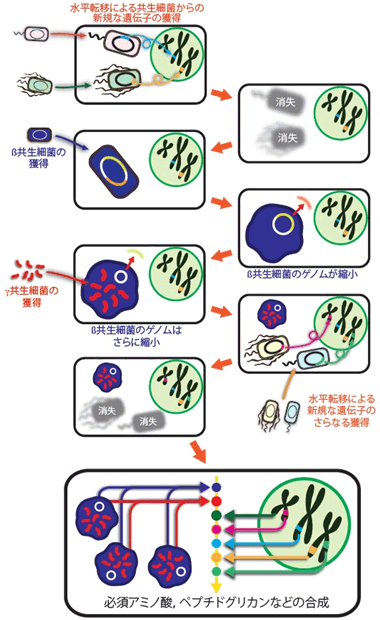
分子系統解析の結果、これら水平転移遺伝子の多くはボルバキア、リケッチア、ソダリス、アルセノフォナス、カルディニウムなど、昆虫類に広く見られる非必須の共生細菌の遺伝子に近縁であることが判明した。しかし現時点では、ミカンコナカイガラムシはこれらの共生細菌に感染していない。おそらくコナカイガラムシ類の祖先が、これらの共生細菌に感染していた時期があり、遺伝子の一部を核ゲノムに水平転移した後に、感染が失われたものと推定される(図7)。
 |
|
図7 ミカンコナカイガラムシの内部共生システムの進化過程の概念図 |
今回の発見は、生物における個体、細胞、ゲノムとは何か、それらはどのように構築され、進化してきたのかという根源的な問いに新たな観点を提示する。例えば細胞内共生説において、ミトコンドリアや葉緑体のように細胞内小器官として残ったものは一部にすぎず、大部分の共生細菌は一部の遺伝子のみを宿主核ゲノムに水平転移したうえで消失したのではないか、そのような水平転移遺伝子も真核細胞の進化に寄与してきたのではないか、初期の真核細胞は多数の細菌のキメラとして生じたのではないか、といった仮説に具体的な根拠を与えるものである。
今後はコナカイガラムシの内部共生システムを構築する宿主昆虫の遺伝子、β共生細菌の遺伝子、γ共生細菌の遺伝子、そして水平転移遺伝子がコードするタンパク質などの遺伝子産物の機能解析を進め、この複雑な共生システムがどのように構築され、働いているのかを具体的に解明していく予定である。
さらに、多様な生物における内部共生システムの探索と解明を進めていくことにより、コナカイガラムシで発見されたこの現象が、特殊なものなのか他の生物でも見られるのかを明らかにし、共生進化と遺伝子水平転移の関係について追求していきたい。