AI創薬とは?
AI創薬とは?
2025/02/12

AI創薬
とは?
科学の目でみる、
社会が注目する本当の理由

AI創薬とは?
AI創薬とは、AI(人工知能)を用いて新しい医薬品の開発を効率化し、加速させることです。AIは膨大な量のデータを処理することを得意としており、疾患治療のための標的探索や、医薬品の候補となる分子の探索・デザイン、その分子の体内での効果や安定性の予測などを行うことができると期待されています。
日々進化を続けるAI技術。創薬プロセス(医薬品開発プロセス)においても、AIを活用する取り組みが広がっています。AIが膨大なデータを処理して、疾患治療の標的(タンパク質など)の探索、医薬品候補となる分子の探索やデザインを行えるようになってきました。2024年のノーベル化学賞も関連する技術が受賞しました。AI創薬が注目される理由やAIが使われる場面、課題などについて、細胞分子工学研究部門生物データサイエンス研究グループの今井賢一郎研究グループ長に聞きました。
なぜAI創薬が注目されているのか
AI創薬とはなにか
AI創薬とは、新しい医薬品を開発するプロセスである創薬においてAIを活用することです。
AIを活用し、大量の生体内分子データ(統合的なオミクスのデータなど)を解析すれば、例えば疾患に関わる代謝経路をより精密に特定でき、疾患と関連する生体内分子(標的候補)を明確にできる可能性があります。さらに、標的となるタンパク質や核酸などの構造を予測・分析し、作用する化合物、ペプチド、タンパク質などをコンピュータ上で最適化するデザインを行ってから、実験して医薬品候補を特定するというフローも可能でしょう。
このように標的を精度よく探索し、あらかじめ新薬となる可能性が高い化合物などを選別・設計してから実験を行うことで、創薬プロセスが効率化され、創薬に費やす時間とコストを削減でき、成功確率が上がると考えられます。従来の手法では、治療薬の開発に着手してから製造販売承認に至るまでに10年以上かかり、開発費用の合計は1000億円を超えると推定されています。さらに、成功確率が非常に低く、例えばリード化合物とよばれる医薬品候補の中から最終的に製造販売承認を取得できる確率は約0.004 %しかないとされています。
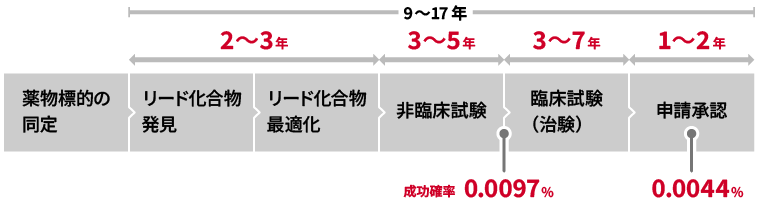 医薬品開発に要する期間と成功確率(参考:厚生労働省「医薬品産業ビジョン2021資料編」)
医薬品開発に要する期間と成功確率(参考:厚生労働省「医薬品産業ビジョン2021資料編」)
開発期間の短縮と成功確率の向上によって創薬コストが下がれば、製薬会社にとって利益が出にくいとされる、患者数が少ない希少疾患の治療薬開発にもチャレンジしやすくなります。また、医薬品の価格が下がれば、発展途上国など所得が低い地域でも医薬品を販売しやすくなり、より多くの人の命が救われると期待されています。
各プロセスにおけるAI活用の例
タンパク質の構造予測
多くの医薬品は、体内のタンパク質に作用することで細胞や組織のはたらきを正常に戻そうとします。ヒトのタンパク質のうち、承認薬が効果を及ぼす仕組みや過程(作用機序)が明確にわかっているタンパク質は約3 %、詳細な作用メカニズムは不明ながら化合物と相互作用するタンパク質は約7 %とされています。つまり、約90 %(55 %は疾患と関連する変異を持つ)が新たな創薬標的になり得ることを意味します。
新薬開発の上で重要なのが、標的となるタンパク質の三次元構造(立体構造)です。タンパク質は特有の立体構造を持ち、その構造によって機能を発揮します。しかし、アミノ酸の変化によって本来の立体構造が変化するとタンパク質は正しく機能せず、疾患の原因になることがあります。また、医薬品の薬効を発揮するには、医薬品がタンパク質の特定の構造に結合し、その機能を調節することが必要です。
ところが、ヒトの全タンパク質のうち、立体構造がわかっているものは30 %弱しかありません。新薬開発の標的であるタンパク質の構造がわからなければ、医薬品候補の探索が格段に難しくなるというわけです。
この問題に風穴を開けたのが、ディープマインド社が開発したAlphaFoldというAI技術です(産総研マガジン 2024年ノーベル化学賞「 タンパク質設計と立体構造予測とは?」)。AlphaFoldは、タンパク質のアミノ酸配列から立体構造を高精度に予測するAIです。2020年に発表されたAlphaFold 2は、これまでの立体構造予測法をはるかにしのぐ性能を示し、大きな話題になりました。2024年度のノーベル化学賞を受賞したことがその技術の高さを裏付けています。
2023年5月には、新たなモデルとなるAlphaFold 3が発表されました。AlphaFold 2はタンパク質単独の構造やタンパク質の複合体を予測するのに対して、AlphaFold 3は化合物と結合した状態も予測できるようになりました。次世代の医薬品や創薬標的としても注目されているRNAとの結合(産総研マガジン 2023年ノーベル生理学・医学賞 「mRNAワクチンを実現した修飾塩基の研究とは?」)も予測します。そのため、AlphaFold 3は創薬への応用を重視して開発されたと考えています。
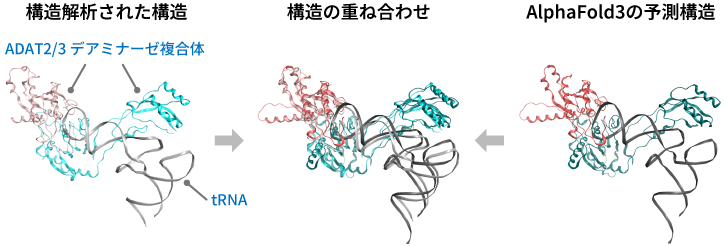 AlphaFold 3によるタンパク質とRNAの結合予測
AlphaFold 3によるタンパク質とRNAの結合予測
コンピュータ上で化合物との結合を予測するバーチャルスクリーニング
さまざまな化合物の中から、医薬品候補となる化合物を選別することをスクリーニングといいます。標的がわかっている場合は、標的分子に結合する化合物を選別する「標的ベーススクリーニング」が用いられ、標的がわかっていない場合は、細胞などの表現型変化を指標にする「表現型スクリーニング」が用いられます。また、ロボットを使った(半)自動化された方法で、数万から数十万種類の化合物を調べる「ハイスループットスクリーニング」という方法もあります。
これらの方法に対して、大規模な化合物ライブラリ(数百万種以上の化合物)に対し、コンピュータ上でタンパク質と化合物の結合を予測し、候補化合物を選別するのが「バーチャルスクリーニング」という方法です。バーチャルスクリーニングで得られた結果をもとに、実際に実験で化合物を合成し検証するというプロセスは、効率化な創薬開発に欠かせないものになっています。
現在、化合物ライブラリは急激に拡張され、コンピュータ上で合成可能と予測される化合物も含めると、数十億種類以上のものもあります。このような超大規模な化合物ライブラリに対し、AI技術による現実的な時間でバーチャルスクリーニングを行うための高速化が求められています。また、標的タンパク質にあわせ、結合する可能性の高い化合物を設計するというAI技術の開発も行われています。
体内の化合物動態予測
スクリーニングによって薬の候補になった化合物でも、体内で分解されやすかったり、逆に毒性があったりする場合があります。このような体の中での化合物の動きを薬物動態といいます。AIにより、体内に化合物を摂取した時の吸収、分布、代謝、排泄、毒性といった物性について予測できるようになってきています。実験前に化合物の薬物動態を精度良く予測できれば、創薬にかかるコストを削減することが可能です。
AI創薬発展の鍵と課題
AI創薬が発展することで、上記のように、創薬プロセスの中でも、特に初期段階である標的選定がさらに加速すると期待されています。また、これまでの医薬品開発は低分子が主流ですが、AIにより、標的タンパク質を制御するタンパク質の設計も可能になる時代になってきました。さらに、核酸医薬品の開発、遺伝子治療、細胞治療、再生医療などを促進させるAI技術も登場してくると考えています。
医療ビッグデータの活用
AI創薬がさらに発展するための鍵は、医療ビッグデータやヘルスケアデータの活用にあります。ゲノムデータや血中のさまざまな生体分子データが重要なのはもちろんですが、投薬情報などの医療ビッグデータと組み合わせることで、標的探索がさらに進み、疾患のメカニズムの解明も進むと考えられます。また、日常的なヘルスケアデータと組み合わせることができれば、未病や疾患の予後を予測することもできるようになると考えています。スマートフォンやスマートウォッチで計測できる活動量や心拍数、睡眠時間等だけでなく、AIの自然言語処理技術や画像解析を使えば、患者やその家族が書く手書きの「観察記録」までもが貴重な情報になりえます。(産総研マガジン「自然言語処理とは?」「生体機能計測とは?」)
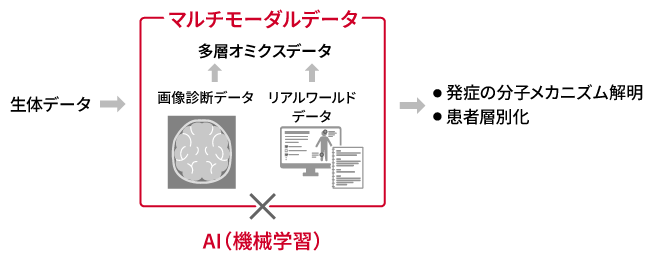 患者のさまざまなデータをAIで解析して疾患の原因解明につなげる
患者のさまざまなデータをAIで解析して疾患の原因解明につなげる
その一方で、AI創薬に向けての課題もあります。まず、個人情報の取り扱いについてです。AIが学習して性能を上げるためには大量のデータが必要になりますが、医療データをどうやって大量に集めるかという課題があります。医療データは病院単位で管理されていることが多く、セキュリティを担保しながら複数の病院をまたいで患者個人ごとのデータを結びつけることが難しいのです。ただ、さまざまな医療データを患者個人に返し、患者が簡便に管理・利活用できるような仕組みを作れば、さまざまな医療データが患者個人のもとで紐付けされ、患者の同意の下に大規模な医療データを集めることも可能になるかもしれません。(産総研マガジン「サイバーフィジカルセキュリティとは?」)
データの品質保証と人材育成
また、データの品質保証という点にも課題があります。AIの学習に用いるバイオ関連のデータですが、その品質を保証する取り組みも重要です。品質の保証されないデータで学習されたAIとそのAIより予測された結果は、やはり品質の保証が難しくなります。(産総研マガジン「AIのセキュリティリスクとは?」)
さらに、AI開発を行う人材も欠かせません。ただ、AIと創薬の両方に精通した人材を育てるのは難しいので、それぞれのエキスパートが交流すること、データサイエンス分野の人材が創薬分野に興味を持ち、参入してくることがAI創薬の発展には重要だと考えています。
産総研の取り組み
創薬標的になり得る未知のタンパク質機能部位の発見を目指して
産総研の生物データサイエンス研究グループでは、タンパク質やRNAを対象に新たな創薬標的を探索する技術を開発しています。
特に、クリプティックポケットと呼ばれる、タンパク質と結合できる化合物が近づいたときに初めて結合部位が現れるポケットに注目しています。タンパク質は、そもそも常に同じ構造をとるわけではなく、動的に変化し、その変化は機能と密接に関係しています。その動的な変化をとらえるため、原子レベルの動きをシミュレーションする分子動力学計算を活用し、独自の構造変化解析法や機械学習と組み合わせることで、化合物と相互作用するクリプティックポケットを予測する技術開発を行っています。
また、疾患に関連するアミノ酸変異は、タンパク質の機能部位に周辺によく生じます。この特徴を利用すれば、未発見の機能部位を探索することも可能です。そこで、網羅的に疾患と関連する変異を集め、AlphaFoldなどの構造予測AIも活用しながら、タンパク質の構造上にマップすることで、クリプティックポケットのような未知の機能部位を発見できる技術の開発も行っています。
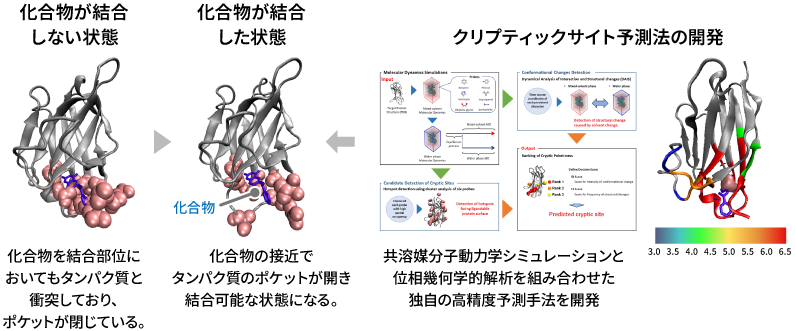 結合可能な化合物が接近した時、タンパク質にあらわれるクリプティックポケット
結合可能な化合物が接近した時、タンパク質にあらわれるクリプティックポケット
ドライ研究とウェット研究のシナジーで創薬・診断・治療をブーストする技術を社会へ
私たちのグループの大きな特徴は、細胞や生体分子などを実験室で扱うウエット研究と、シミュレーションやAIを使ってコンピュータ上で扱うドライ研究の両方ができることです。これらの技術を組み合わせることで、創薬支援だけでなく、RNA修飾によるがん診断技術や遺伝子治療のための高機能ウイルスベクターの開発も進めています。また、共同研究ではさまざまなニーズに対応できると考えます。これらの技術や取り組みに関心のある方は、ぜひお問い合わせください。