ゲノム編集でニワトリが “金の卵”を産んだ!
ゲノム編集でニワトリが “金の卵”を産んだ!

2018/01/31
ゲノム編集でニワトリが “金の卵”を産んだ!アレルゲンの少ない卵、医薬成分を含んだ卵の大きな可能性

 さまざまな産業利用が可能な「組み換えタンパク質」を革新技術で生産したい。
さまざまな産業利用が可能な「組み換えタンパク質」を革新技術で生産したい。
近年、「ゲノム編集」とよばれる遺伝子操作技術が脚光を浴びている。これまでの遺伝子組み換え技術と異なり、遺伝子情報を1文字単位で書き換えたり消去したりできるなど精密操作が可能な画期的技術で、植物や動物の品種改良にも活用が期待されている。
産総研は2016年、この技術を用いて、卵アレルギーの原因物質(アレルゲン)のひとつをもたない卵を産むニワトリをつくることに成功した。そして2017年にはがん治療薬の原料成分を卵白に含んだ卵を産むニワトリをつくりだし、新たな産業利用に向けて大きな一歩を踏み出した。
アレルゲンのない卵ができれば加工食品の安全性は高まる
大石勲が産総研に入所したのは、約10年前のことだ。それまで米国で発生生物学の基礎研究に取り組んできたが、産総研に入ったからには将来的に産業につながるような仕事をしたいと思った大石は、発生生物学で培った遺伝子操作技術を社会に役立てる研究を模索していた。
そんな時、食品メーカーから「卵からオボムコイドを除去できれば、加工食品の安全性はかなり向上する」という話を聞いた。オボムコイドとは、卵に含まれる何種類かのアレルギー原因物質のうちの1つである。他のアレルゲンと異なり熱耐性が高く、加熱してもアレルゲン性を失わないという厄介なものだ。食品アレルギーに悩む子どもは先進国を中心に数多く、日本でも3歳までに食物アレルギーと診断される子どもが16 %以上、そのうち約40 %は鶏卵が原因食物となっている。生死に関わる重篤なケースもあり、アレルギーが大きな社会問題であることは間違いなかった。
「オボムコイドをもたない卵をつくることができれば、食の安全に貢献できるし、市場のニーズもあると考え、ニワトリの品種改良を始めましたが、2011年頃、実用に足るゲノム編集技術の黎明期を迎え、この技術をニワトリに使ってみようと思いました」
もちろんアレルギーは複雑な生体反応であり、オボムコイドがなくなっただけですべての卵アレルギーの子どもが卵を食べられるようになるわけではない。しかし大石は、この研究が成功すれば、さらにその先、食物アレルギー以外にもさまざまなケースへと応用できるのではと考えた。そして手始めとしてニワトリの品種改良にチャレンジすることにした。
鶏卵の生産コストは1個3~5円と非常に安い。そのような低コストで生産できる卵に、ゲノム編集でいろいろな機能を発現させ、医薬品原料などの工業材料として使えるようになれば、それは食物としてだけでなく、広く人の健康に役立つ“金の卵”となるかも知れない。そんな金の卵を産むニワトリを作り、育てることを目指し、ニワトリの遺伝子改変の研究がスタートした。
世界で初めて、ゲノム編集でニワトリの品種改良に成功
ニワトリの卵の場合、含まれるタンパク質が非常に多く、実験室レベルでいろいろな遺伝子改変実験を試すことができる。しかも卵の単価は安いため、経済的負担も小さい。当然、“金の卵”を産むニワトリは誰にとっても魅力的な存在となり、世界各国でニワトリの遺伝子組み換えやゲノム編集が試みられていた。大石にしても、最初の着想は「オボムコイド欠失ニワトリ」だったが、それができることが実証されれば、早く生育するニワトリや病気にかかりにくいニワトリなど、さまざまな応用が可能になることを視野に入れていた。
とはいえ、実際にはニワトリのゲノム編集による品種改良はなかなか実現しなかった。実はニワトリなどの鳥類は、遺伝子操作がとても難しい生き物なのだ。
「生物の遺伝子操作は一般的に、生命の始まりの状態で行います。マウスであれば、受精直後の受精卵という1つの細胞をつかって、そこに極細の針を刺して別の遺伝子を注入していきます。それに対してニワトリの受精直後の卵細胞は、非常に小さな卵細胞が大きな卵黄の表面のどこかに1つ乗っている状態で、それを見つけること自体も難しければ、適切なタイミングで操作することも困難なのです」
しかも、その1つの卵細胞を得るためには雌ニワトリを1羽犠牲にすることになり、実験に使う動物を極力少なくするという方針にも適合しない。また、その段階ではまだ胚と卵細胞を保護する卵白ができていないので、遺伝子操作後の卵細胞を育てること自体もとても難しい。そこがマウスなどとは異なっていた。
「そこで考えたのが、精子の方にゲノム編集を行う方法です。始原生殖細胞という将来的に精子になっていく細胞は、卵細胞に比べて扱いやすく、ここに対してならゲノム編集ができそうだと思いました」
具体的な操作は、次のように行った。まず、雄ニワトリの初期胚から始原生殖細胞を取り出し、クリスパー・キャス9法*1というゲノム編集技術によってオボムコイドをつくる遺伝子を欠損させる。遺伝子改変を施したその細胞を、別の雄ニワトリの初期胚に移植した後に孵化させると、成長したニワトリ(第0世代)の多くが、精子のオボムコイド遺伝子を欠失していた。
次に、オボムコイド遺伝子をもたないこれら第0世代の雄ニワトリを、野生型の雌ニワトリと交配させると、父方由来のオボムコイド遺伝子を欠失したニワトリが生まれた(第1世代)。第1世代の雄雌を交配させると、次の第2世代で、父方、母方両方がオボムコイド遺伝子をもたないニワトリができた。
オボムコイド遺伝子をまったくもたない第2世代ニワトリの健康状態に異常はみられず、野生型と同様に成長。そして、この第2世代の雌ニワトリが産んだ卵はというと、目的どおり、オボムコイドがまったく含まれていなかった。ある遺伝子が欠失することは、自然界でも突然変異として起きることがある。これまでの品種改良は、偶然に出現する有利な特性をもつ個体を選択して行っていたが、ゲノム編集を用いたニワトリの品種改良は、これが世界で初めての成功例となった。
しかし、ここに至るまでは決して順調だったわけではない。ニワトリの場合、1世代が交代するのに8カ月程度かかるため、1回失敗するとそれまでの約1年が水の泡となってしまう。結局、始原生殖細胞に対してのゲノム編集を成功させるまでに4年近い年月を費やした。
「ゲノム編集をしてから第2世代の産んだ卵にオボムコイドがないと確認するまで、約3年かかります。研究の方向が合っているかが見えるまでに、各段階で1年ずつかかるのは精神的に苦しかったですね。でも、辛抱強く取り組み、うまくいく方向を確かめる経験を積んできたことで、やっとここまでたどり着くことができました」
今後はこのオボムコイドを持たない卵をどのように活用していくのか、医師や医薬品、食品メーカーなどとともに、学術研究を中心に将来の応用可能性についても検討を進めていく予定だ。
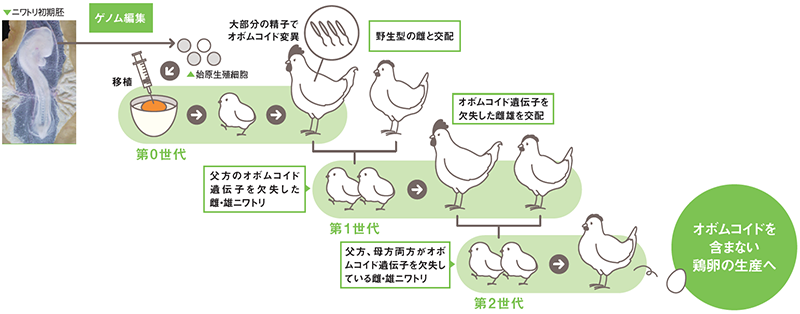 オボムコイド遺伝子を欠失したニワトリの作製法。ゲノム編集を用いて第2世代でオボムコイドを含まない卵を産むニワトリが誕生した。
オボムコイド遺伝子を欠失したニワトリの作製法。ゲノム編集を用いて第2世代でオボムコイドを含まない卵を産むニワトリが誕生した。
医薬成分を含んだ卵の開発に成功新薬誕生につながる可能性
ここまではある要素を“失わせる”方向の品種改良だったが、大石はもう一つ、要素を“加える”方向の研究にも取り組んできた。
医薬品というとかつては化学合成されたものが多かったが、現在はバイオ医薬品と呼ばれる、遺伝子工学を応用した組み換えタンパク質の利用が新薬開発の主流になっている。糖尿病治療薬として使われるインスリンも、がんの治療で使われる抗体医薬も、病気を治療する能力をもった組み換えタンパク質が用いられている。ほかにも再生医療や疾患治療研究などでさまざまな組み換えタンパク質が使われている。
病気の治療に有効なバイオ医薬品だが、大きな課題がある。非常に高価であることだ。その理由には特許や知財面の要因に加えて、遺伝子改変を施した培養細胞を培地で増やしてタンパク質を分泌させるという製造法の問題が大きい。これには巨大なプラントが必要となり、プラント建設自体に巨額な費用がかかり、さらに、生物なので温度管理などの生産管理を24時間体制で行うため、管理コストも莫大になるのだ。
「もっと安く生産することができれば、バイオ医薬品の価格を下げることができますし、組み換えタンパク質をよりさまざまな医薬品開発に使うことができます。さらに将来的には機能的なオーラルケア製品やヘアケア製品、化粧品、サプリメントなどの日常生活品にも応用できるようになると考えています」
低コストの製造ということで大石がイメージしたのは、ゲノム編集で生み出したニワトリを育て、卵を量産する設備だ。すでに食用の卵を大量に生産する養鶏工場がたくさんあるため、ニーズがあれば医薬品用の卵を生産する設備も運営できるはずだ。
例えば産総研の研究でも、遺伝子組み換えにより医薬成分を含んだイチゴをつくり、それを植物工場で生産してイヌ用の歯肉炎薬の原料とするという研究が実用化されている。大石はこれと同様に、品種改良したニワトリを育てる施設を建設することで、安く、大量に医薬品などの有用成分を得られるようにしようと考えている。
2017年、ゲノム編集によって品種改良したニワトリに、疾患治療や免疫研究などで用いられるインターフェロンβを多量に含んだ卵を産ませることに成功した。この要素技術の完成で、低コストでバイオ医薬品をはじめとする組み換えタンパク質を製造する道筋がつけられたのである。
「企業と連携して研究用試薬の商品化に向けた開発を進めていく中で、組み換えタンパク質の生産コストを大きく下げる可能性が見えてきました。今後は、いろいろな企業に組み換えタンパク質のニーズを聞きながら、一緒にニワトリの卵を使った低コスト、大量生産技術を確立したいと思います」
研究開始から7年、産業界に大きなインパクトを与える重要な要素技術が完成した。とはいえ、インターフェロンβよりも複雑で大きな分子をつくるための技術や、より短期間で効率よく有用な成分を得るための技術、研究を短期間で評価する技術の開発など、やるべきことはまだいくつもある。大石は現在、それらの研究開発を進めている。
「夢は、毎日1トンの組み換えタンパク質をつくる技術を開発し、組み換えタンパク質の値段を現在より2~3桁下げること。そして、そういったタンパク質を、これまで誰も想像しなかったような用途に活用していくことです」
大石は同じ夢を見れる企業とともに、この夢を実現させたいと願っている。
*1: クリスパー・キャス9法。操作したいDNAを狙って、簡単かつ高確率に目的の遺伝子を改変できる技術。標的部のDNA部に対応するガイドRNAと切断役の酵素キャス9を導入すると、標的の近くにある目印に接してキャス9がDNAを切断し、削除・置換・挿入など自在な編集が可能となる。[参照元に戻る]
バイオメディカル研究部門
先端ゲノムデザイン研究グループ
研究グループ長
大石 勲
Oishi Isao