マラリアの正確な早期発見を実現!
マラリアの正確な早期発見を実現!

2017/07/31
マラリアの正確な早期発見を実現!多くの命を救う細胞チップでの診断技術開発

 ❶ 従来の診断法と比べて、検出感度が桁違いの超高感度に。
❶ 従来の診断法と比べて、検出感度が桁違いの超高感度に。
❷ 誰でもどこでも簡単に操作できる診断装置を開発。
❸ アフリカの過酷な環境の中でフィールドテストを重ね実用化へ。
「マラリア」は毎年2億人が感染し43万人が命を落とす世界三大感染症のひとつである。このマラリア感染による死亡や重篤化を防ぐには効果的な薬剤の開発とともに、正確で高感度、かつ迅速で簡単な診断方法が必要となる。しかし、現在確立されている診断方法には一長一短がありすべての要件を満たす方法はまだ存在しない。
産総研は従来の診断法とは異なる細胞チップ技術を応用した方法に着目し世界最高の精度を有し、迅速で簡単な診断技術の開発に成功。現在は実用化に向けて現地アフリカでフィールドテストを行いながら研究開発を続けている。
精度も使いやすさも備えたマラリア診断法の開発を目指して
片岡正俊は元々歯学分野の研究者だったが、バイオマーカーによる疾病診断研究に出会い、その面白さに惹かれて臨床検査医学・診断デバイス開発の分野に転身、産総研には2006年に入所した。ほどなく同じ研究グループに、マラリア原虫を用いて小胞輸送研究をしていた八代聖基、微細加工技術を専門とする山村昌平が加わった。
「集まった研究者の多様なバックグラウンドを生かして何かできそうだ」――片岡は、このチームで、いまだに多くの人を死に至らしめるマラリア感染症の診断法の開発に取り組むことを決意した。当時、マラリア感染症の診断法には主に3つの方法があったが、いずれも一長一短があり、課題も大きかった。
WHO(世界保健機関)が基準とする診断法は、患者の血液の赤血球を染色して光学顕微鏡で観察するという方法だ。しかしこの方法は、観察者の熟練度に左右されるうえに、数万個の赤血球を観察するので時間もかかる。しかも、感染初期での見極めが難しく、感染の見落としや治療の遅れにつながりやすいという問題があった。
2つめのRDT法(迅速診断法)はマラリア原虫に特異的なタンパク質を見つける方法だ。操作は簡単で、結果が出るまで約20分と迅速でもあるが、問題は偽陽性*1が出やすく誤診の恐れがあることだった。また、判断できるのは感染の有無だけで、感染率はわからない点も欠点といえた。
「偽陽性が出ると、薬の不要な人にも薬を投与することになり、薬剤耐性マラリアの蔓延につながります。かつて有効だった抗マラリア薬の効果が薄くなっているという現状もあり、それは避けなくてはなりません」と片岡は言う。
3つめのPCR法(ポリメラーゼ連鎖反応法)は、高価な専用装置や試薬が必要なうえに、操作が複雑で、検出までに数時間を要するという難点があった。つまり、精度も使いやすさも兼ね備えたマラリア診断法はこれまで存在しなかったのだ。そこで片岡らは、感染初期から正確に診断でき、かつ、誰でもどこでも簡単に操作できる診断法の開発を目標に据えた。
 マラリア診断法の比較
マラリア診断法の比較
マラリア原虫感染赤血球の数を簡単かつ正確に数える方法は?
片岡は感染の有無に加えて、感染率の測定も必須だと考えた。感染の進行度を知ることができれば、効果的な治療が可能になるだけでなく、薬剤耐性原虫の出現リスクを抑えることにもつながるからだ。
感染率を知るには原虫に感染した細胞の数を数えればよいのだが、既存の診断法では、膨大な赤血球を計測しなければ正確な感染細胞数を把握できず、迅速な診断が困難だった。しかも、装置も高額になってしまい、実用的とはいえなかった。
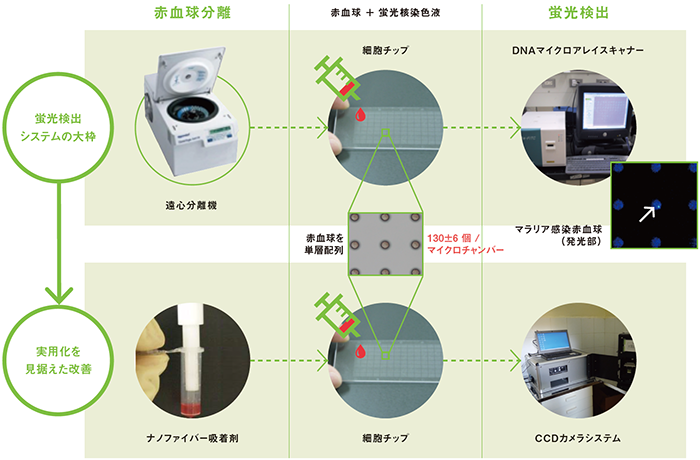
片岡たちがこの難点を克服するために考えた方法が、多くの赤血球を細胞チップ上に単層に並べ、原虫に感染した赤血球だけを検出し、感染率を算出することだった。
「正常な赤血球には核がなく、マラリア原虫が感染した赤血球には原虫の核が存在します。つまり、赤血球に寄生したマラリア原虫の細胞核のDNAを蛍光染色すれば、蛍光に発色している赤血球を数えることで原虫の数を測定できるのです。これに気づいたことが成功への第一歩となりました」
しかし、細胞チップ上の血液の赤血球が何重にも重なっていると、染色しても細胞数を正確に数えるのは難しい。高精度な測定のためには、測定対象の細胞数を一定数確保しつつ、それらを単層に並べ測定をしやすくする必要があった。チームが考えた方法は、細胞チップ上に赤血球細胞を単層で多数並べることのできるマイクロチャンバー(細胞を格納する微細な部屋)を作成することだった。これができたら画期的な診断法が開発できる、チーム全員が意気込んだ。
細胞チップで270万個の赤血球を一度に解析
細胞を一定数ずつ正確に配列するマイクロチャンバーという明確な開発目標に向け、チームは議論を重ねた。マイクロチャンバーの直径と深さをコントロールすれば、細胞を一定数で並べられるのではないか。感染率を求めるうえで、1つのチャンバーには100個程度の赤血球が入ることが好ましかった。そこで1個の原虫を確認できれば、感染率は1 %となる、そこからマイクロチャンバーの直径を決め、目標とする検出感度と作りやすさなどからチャンバーの数を2万944個と決定した。
次の課題は赤血球を単層で並べることだった。実験の過程の中で、チャンバー内に堆積した赤血球を緩やかに生理食塩水などで流すと、チャンバー底面に一層だけ赤血球が残ることがわかった。しかも1つのチャンバー内に残る赤血球の数は130±6個と、ほぼ一定である。こうして約270万個の赤血球を一度に解析できる細胞チップの大枠ができあがった。
チームが次に取り組んだのは、マラリア原虫の検出法だ。シンプルな操作で検出・解析できるデバイスの開発は、パナソニック株式会社との共同研究により進められた。
「マラリア原虫だけでなく、血液中の白血球も核を持っています。蛍光染色によって原虫を数えるには、白血球を血液から除去しなくてはなりません。通常は遠心分離機を用いて除去しますが、停電が多い地域では電気が使えないため、ナノファイバーを吸着剤として用いることにしました。また、蛍光の検出法も低コストの方法を探し、CCDカメラシステムを採用しました。いずれもパナソニックの技術を応用したものです」
研究開始から2年後には、200万個の赤血球中に1個のマラリア原虫が感染した赤血球の検出が可能となり、既存の診断法に比べて桁違いの超高感度検出が可能な世界トップレベルのマラリア診断法ができあがった。この検出感度であれば、発症前に感染を見つけることができる。さらに、既存法の中でも最速だったRDT法を上まわる15分という短時間で検出が可能となった。こうして高感度で迅速にマラリアを診断できる技術は完成した。
「しかし、大変だったのはこの後です」と片岡は苦笑する。
実験装置は完成し、過酷なフィールドテストに挑む
この結果を論文にして発表すると、外部の専門家から「マラリア流行地でのフィールドテストが必要だ」とコメントがついた。研究室で高精度の検出ができても、過酷な環境のマラリア流行地で同じような数値が出るとは限らない、現地で使えなくては意味がないということだった。
片岡らは現地での協力機関を探して奔走した。大阪大学微生物病研究所堀井俊宏教授の協力により、アフリカ・ウガンダ第二の都市グルの中核病院が研究拠点として利用できることになった。だが実験室で完成した診断装置を持ち込んだグルの環境は、日本では想像もつかないものだった。
「ウガンダの首都カンパラから病院までは、車で7時間の悪路で、精密機器の運搬には過酷な環境でした。中身に振動が伝わりにくい弾薬運搬ケースを用いてさえ、病院に着いたときには装置は壊れていました。病院では停電は当たり前ですし、窓を閉めていても室内は砂埃だらけになる。解析に使用するために街で買ってきたミネラルウォーターも使えるものではありませんでした」こうした厳しい環境に加え、アフリカの多くの村には医師や看護師がいない。
「日本で言うところの“ヘルスワーカー”が地域の人々の健康を管理していますが、複雑な医療機器の操作は難しく、誰でも何処ででもボタンひとつで解析のための操作ができるようなところまで、機器を簡便にする必要がありました」
パナソニックの研究者と新たに研究グループに配属された橋本宗明も加わった開発チームはこの多難な状況に戸惑ったが、誰も諦めるつもりはなかった。患者サンプルの解析のために、チームは年に何度もアフリカに赴き、現地での調査結果を日本に持ち帰って改良を加えた。完成すれば間違いなく多くの人の役に立つこの技術を、なんとかしてウガンダで確立して世界に広げたいというチーム全員の志と情熱は消えなかった。
 ウガンダの子供たちと試作機を手にする産総研 橋本研究員。
ウガンダの子供たちと試作機を手にする産総研 橋本研究員。
「マラリアの犠牲者の多くがアフリカの子どもたちです。貧困と感染症は連鎖しており、それが地域社会を苦しめる一因となっています。私たちの技術でマラリア感染による死亡や重症化を抑え込むことができたら、その連鎖を断ち切ることができるかもしれません。私たちの技術はアフリカの社会、そしてマラリアに苦しむ他の地域にも貢献できるのです」
現在、片岡らはマラリア解析デバイスの3年以内の実用化・普及を目指し、防塵対策の強化やゴミを誤検出しない解析法の開発など、現地での使いやすさを向上させる改良を進めるとともに、WHOの推奨を得るための努力を続けている。
血中循環がん転移・再発の早期発見にも期待
さらにこの技術は、がんの原発巣から血管の中へ侵入して遠隔臓器へ転移する血中循環がん細胞を正確に見つけることが可能で、その臨床応用が期待されている。がんの転移を起こす血中循環がん細胞を正確に検出できれば、将来のがん転移の予想が可能となり初期段階で的確な抗がん剤投与などの治療を始めることができる。

さらに、がん組織の中で極わずかに存在し増殖や転移を司るがん幹細胞が注目されている。現状では、抗がん剤など治療の効果はがん組織の大きさの変化で評価されることが多いが、一時的に組織が縮小しても再度大きくなることや、遠隔臓器に転移することも多い。がんの本態とも言えるがん幹細胞の検出と薬剤耐性などの性状を調べることで、個々のがんに最も適した治療法選択に結びつくことが期待される。
「これまでの技術では大きな固形がんからわずかに存在する幹細胞を見つけるのはほぼ不可能でしたが、循環がん細胞の中にはがん幹細胞が存在するはずです。循環がん細胞の集団の中からさらに幹細胞の検出と解析を行うことで、個々のがんに合わせた最も効果的ながん治療の選択につながると思います」

マラリアの早期発見と適切な治療だけではなく、血中循環がん細胞の正確な定量検出にも応用できるこの技術は、今後、マラリア感染症とがんの領域で広く医療に貢献できる可能性を秘めている。
*1: 偽陽性。マラリア原虫に感染していないが、陽性反応とでること。偽陽性患者に抗マラリア薬を投与することで、不必要な薬剤を環境中に広め薬剤耐性マラリアの発生・蔓延の可能性を高める。[参照元に戻る]
健康工学研究部門
バイオマーカー診断研究グループ
研究グループ長
片岡 正俊
Kataoka Masatoshi