国立研究開発法人 産業技術総合研究所【理事長 石村 和彦】(以下「産総研」という)生物プロセス研究部門【研究部門長 鈴木 馨】生物共生進化機構研究グループ 古賀 隆一 研究グループ長、棚橋 薫彦 元産総研特別研究員(現台湾師範大学研究員)、森山 実 主任研究員、深津 武馬 首席研究員らは、マルカメムシの母虫が産生する共生細菌カプセルの内容物を分析し、単一の新規な分泌タンパク質が大部分を占めることを発見した。このタンパク質が宿主体外で脆弱な共生細菌を保護することにより、共生細菌の次世代への伝達が可能になっていることを解明した。また、メス成虫の寿命がカプセル産生により短縮することがわかった。すなわち、母虫は「命を削って」子のために共生細菌カプセルを作っていることになる。
この成果は、微生物との共生に必須な宿主側の因子を明らかにしたものであり、共生維持の分子機構の解明につながる新規な発見である。微生物との共生が、親子間の依存関係の進化にどのように関わるのかという観点からも、興味深い知見である。
この成果の詳細は、2021年6月14日(米国東部時間)以降に米国の学術誌「Proceedings of the National Academy of Sciences USA」(米国科学アカデミー紀要)にオンライン掲載される。

産卵中のマルカメムシ (左)背面 (右)腹面
卵の間に見える褐色の塊が共生細菌カプセル
生態系の中で、多種多様な生物は、それぞれの生息環境に適応するのみならず、互いに相互作用しながら共進化してきた。そのような生物多様性の中における生物間相互作用から生じた高度な生物機能は、基礎生物学的に興味深いのみならず、新規な生理活性物質や医薬のリード化合物などにつながる生物遺伝子資源として、さまざまな形で応用的に利用されてきた。しかし生物多様性は膨大であり、未探索の領域はまだ至るところに残されている。
産総研生物プロセス研究部門では、多様かつ身近でありながら未知の部分も多い昆虫類について、特に微生物との共生関係に着目した研究を展開している。カメムシ類は世界に40,000種以上、日本には1,500種以上が分布し、農作物の害虫が少なからず含まれる。多くのカメムシ類では、特定の腸内共生細菌が生存に必須であり、産総研ではこれまでに「環境細菌から進化する共生細菌」(2016年1月11日産総研プレス発表。本リリース最後の【関連記事】を参照)など、カメムシ類と微生物の共生関係における新規生物機能について世界を先導する研究成果を挙げてきた(2007年6月13日、2012年4月24日、2013年6月11日、2014年9月26日産総研プレス発表)。
マルカメムシ類は、腸内に特定の共生細菌(イシカワエラ Ishikawaella)を保有しており、共生細菌なしでは正常に成長や繁殖ができない。共生細菌も、長い共生進化の過程において外部環境中で生きていくために必要な多くの遺伝子を喪失し、ゲノムが縮小し、宿主体外で生存する能力を失っている。マルカメムシは、植物上に卵を産むときに、小さな褐色の塊を一緒に産みつける(動画1)。この塊は「共生細菌カプセル」と呼ばれ、内部に共生細菌が詰まっており、ふ化幼虫が口吻(こうふん)を突き刺して内容物を摂取することにより、共生細菌が次世代に伝えられる。すなわち、脆弱な共生細菌がカプセルに封入されることで、卵がふ化するまでの1週間以上、過酷な外環境を生き延びることができる。産総研ではマルカメムシの共生細菌について研究成果を挙げてきたが、このカプセルがどのような成分からできており、どのような機能を担うのかは不明であり、今回その解明に取り組んだ。
なお、本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 総括実施型研究(ERATO)「深津共生進化機構プロジェクト」(JPMJER1803、JPMJER1902)および文部科学省科学研究費補助金(JP25221107)の支援を受けて実施した。
動画1 卵および共生細菌カプセルを産むマルカメムシ(30倍速)
マルカメムシの消化管を摘出して組織学的に調べたところ、中腸の後部が共生細菌を保有するための共生領域となっていた。特にメス成虫では、共生領域の後部に太くなった膨大領域、さらに後端に暗色で球状の末端領域が発達していた(図1)。これらは共生細菌カプセルを産生するための構造であり、共生領域から供給される共生細菌が、膨大領域において分泌物に包まれ、その共生細菌と分泌物の混合物が末端領域に貯蔵される。そして末端領域の上皮からキチン質の層状の「殻」が分泌され、産卵時に共生細菌と分泌物が殻に包まれてカプセルとして排出される。このように、共生細菌カプセルを形成する仕組みを明らかにした(図2)。
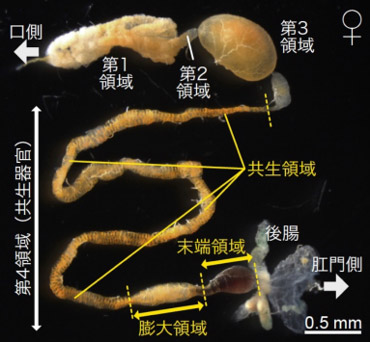
図1 マルカメムシのメス成虫の消化管
消化管のうち、口側にある中腸第1、2、3領域は消化吸収を行い、肛門側の第4領域は長大に発達した共生器官となっている。
メスにおいて第4領域はさらに共生細菌保持およびカプセル生産のための共生領域、膨大領域、末端領域に分化している。
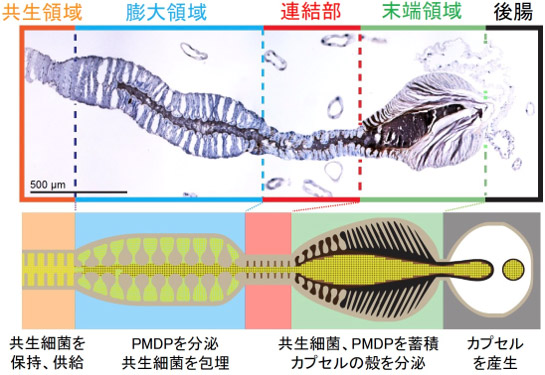
図2 マルカメムシのメス成虫における共生器官の構造と機能
上図は組織切片の顕微鏡写真。宿主細胞核を紫色に、PMDPを褐色に染色してある。
下図は共生器官の構造の模式図および各領域の機能を示す。
これら消化管の各領域および共生細菌カプセルにおけるタンパク質および遺伝子発現を調べたところ、1種類のタンパク質がカプセル内構成タンパク質の大部分を占めていた。このタンパク質はメス中腸の膨大領域および末端領域で大量に合成・分泌されて、共生細菌とともにカプセルに充填されていた。このタンパク質をPMDP(Posterior Midgut Dominant Protein:後部中腸優占タンパク質)と名付けた。
PMDPの機能を調べるために、マルカメムシのメス成虫においてRNAi法を用いてPMDP遺伝子の発現を抑制した(以下、「PMDP抑制」)。すると、共生器官内の共生細菌が死滅して、カプセル数の減少、小型化、透明化が起こり、やがて共生細菌カプセルのない卵塊を産むようになった(図3、動画2)。

図3 RNAi法によるPMDP抑制がマルカメムシの共生細菌カプセル生産に与える影響
カプセルが小さく透明になり、数が減り、やがてカプセルのない卵塊を産むようになる。動画2を参照。
動画2 カプセルタンパク質(PMDP)を抑制したマルカメムシの産卵行動(20倍速)
マルカメムシの正常卵塊において、ふ化幼虫はカプセル内容物を1時間ほど吸ってから静止し、卵殻の近くに集団をつくる。ところがRNAi法で処理したメスが産んだ卵塊では、ふ化幼虫は静止期に入ることなく歩き回り、集団をつくることはなかった(図4、動画3)。これは共生細菌カプセルを探し続けたためで、実際にRNAi法で処理したメスが産んだ卵塊由来の幼虫は、共生細菌を獲得することができず、正常卵塊由来の幼虫に比べて成長が著しく遅滞した(図4)。
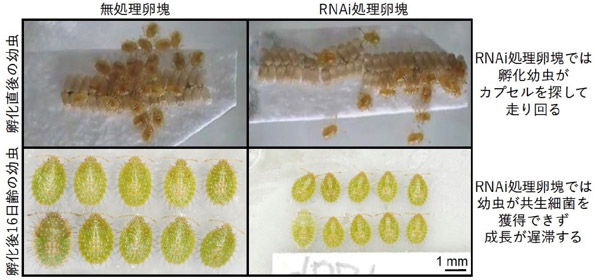
図4 RNAi法によるPMDP抑制がマルカメムシふ化幼虫の行動および生育に与える影響
PMDP抑制によるカプセルなしの卵塊からふ化した幼虫は、共生細菌を獲得することができず、行動異常を示し(動画3を参照)、発育が著しく遅滞する。
動画3 カプセルタンパク質(PMDP)を抑制したマルカメムシが産んだ卵塊由来の孵化幼虫の行動 (20倍速)
PMDP抑制によりカプセルを産生しなくなったメス成虫は、正常なメス成虫よりも死亡率が低下し、寿命が延長した(図5)。これは、「命を削って」子どものために共生細菌カプセルを作っているように見える。
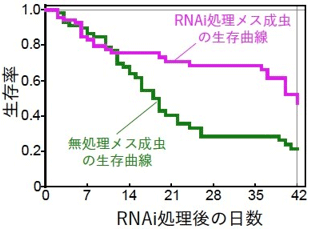
図5 RNAi法によるPMDP抑制がマルカメムシのメス成虫の生存に与える影響
カプセル生産が低下するRNAi処理後10日ごろから生存率が顕著に改善する。
今回、マルカメムシにおいて、宿主体外における共生細菌の生存および次世代の宿主への伝達に関わる、宿主由来の新規分泌タンパク質を同定した。微生物との高度な共生関係に必須な宿主側の因子を明らかにしたものであり、共生の分子機構の理解に新たな光を当てる発見である。一般に、共生細菌は長い進化の過程で遺伝子を次第に失い、ゲノムが縮小し、遺伝的・機能的に劣化していくと考えられている。今回発見したタンパク質は、宿主側がそのような共生細菌の脆弱化に対抗するために獲得した仕組みであると考えられ、共進化の観点からも興味深い。また、このタンパク質は脆弱な共生細菌を宿主体外で保護する機能を持つことから、培養困難な微生物の保存や維持に利用できる可能性があり、新規微生物資源の開発や利用への展開も期待される。
今後は、遺伝子操作技術を用いてこのカプセル特異的分泌タンパク質PMDPを多量に生産し、その性質を詳しく調べるとともに、その共生細菌保護作用が培養困難な微生物の保存や培養に利用できないか検討する予定である。