ドイツ ヨハネスグーテンベルク大学、マックスプランク化学生態学研究所、ハンブルク大学は、国立研究開発法人 産業技術総合研究所【理事長 石村 和彦】(以下「産総研」という)生物プロセス研究部門【研究部門長 鈴木 馨】深津 武馬 首席研究員、生物共生進化機構研究グループ 福森 香代子 元日本学術振興会特別研究員(現 国立環境研究所 博士研究員)と協力して、湿地に生息し、幼虫は水中で植物の根から汁を吸い、成虫は陸上で葉を食べるという特異な生態をもつネクイハムシ類の消化管やマルピーギ管にいる共生細菌マクロプレイコーラのゲノム解読と機能解析を行った。その結果、多くの遺伝子を失って著しく小さくなった共生細菌ゲノムの機能は、植物の汁に不足しているタンパク質の合成に必要な必須アミノ酸などの栄養素供給と、ハムシ自身は持っておらず植物の細胞壁の消化に必要なペクチン分解酵素の生産に特殊化していることを解明した。
今回、1種類の共生細菌が同じ宿主昆虫の幼虫と成虫で全く異なる機能を果たしうることを初めて明らかにした。共生進化の過程を理解するうえで興味深い新知見であるとともに、ネクイハムシ類の中には、稲やレンコンを加害するイネネクイハムシのような害虫が含まれることから、共生細菌を標的とした新たな害虫防除法の開発につながる可能性も期待される。
この成果は2020年6月11日(英国夏時間)に国際学術誌Nature Communicationsにオンライン掲載される。

キアシネクイハムシの成虫(左)と幼虫(右)
微生物の高度な生物機能の理解や利用は、バイオテクノロジーなどさまざまな形で人間社会に役立っている。近年、農業害虫や衛生害虫の蔓延や病害に体内微生物が重要な役割を果たしていることや、人類の健康や疾病に腸内微生物が大きく影響することが判明し、共生微生物の重要性が基礎的、応用的、医学的に一段と大きな注目を集めるようになってきた。
昆虫類は地球上の生物多様性を代表するグループであり、多くの害虫種や有用種を含み、人間社会にも重要な関わりがある。このような昆虫類の多様性の基盤の1つとなっているのが、卵、幼虫、蛹、成虫を経る「変態」である。例えば、チョウやガの幼虫は植物の葉を食べ、成虫は花の蜜や樹液を吸うなど、同じ種であるにも関わらず、発生段階に応じて異なる食物や環境を利用できる。さまざまな昆虫類で共生微生物が重要な働きをしていることは知られていたが、共生微生物と昆虫の変態との関わりについてはよくわかっていなかった。
産総研では以前から、昆虫の体内に共生する微生物に注目し、さまざまな新しい生物機能や、宿主と微生物の高度な相互作用を明らかにしてきた。共生細菌が昆虫に重要な栄養素を供給している例として、衛生害虫に必須栄養素を供給する細胞内共生細菌の機能解明(2009年12月22日、2014年7月1日 産総研プレス発表)やチロシン合成に特化して甲虫の外骨格硬化に関わる共生細菌の発見(2017年9月19日 産総研プレス発表)などが、共生細菌が昆虫の植物利用に重要な役割を担う例として、共生細菌による植物適応および害虫化(2004年3月26日、2007年6月13日 産総研プレス発表)や共生細菌の酵素供給による葉の消化(2017年11月17日 産総研プレス発表)などがある。
ハムシ類は植物の葉を食べることに特化した甲虫のグループで、世界で約40,000種、日本では約800種が知られている。ほとんどのハムシ類は幼虫も成虫も同じ植物種の葉を食べるが、特異な生態をもつのがネクイハムシ類で、幼虫は水中で植物の根から汁を吸い、成虫は陸上で葉を食べる。ネクイハムシ類の共生細菌や共生器官については1930年代に顕微鏡観察による先駆的な報告があり、2000年代には遺伝子の塩基配列に基づく分子系統解析により共生細菌にマクロプレイコーラ(Macropleicola spp.)の暫定学名が与えられたが、その生物学的機能については全く不明であった。
そこで今回、日本とヨーロッパのネクイハムシ類4属26種の共生細菌のゲノム配列を決定し、ゲノム情報から推定される共生細菌の生物機能の解明に取り組んだ。
なお、本研究の一部は、文部科学省 科学研究費補助金(JP17H06388)の支援を受けて実施した。
ネクイハムシ類は湿地にみられる体長5-12 mmほどの小さな甲虫で、幼虫は水中に生息する(図1)。幼虫の尾端に1対の大きなかぎ爪があり、水草の根に差し込んで体を固定し、口から植物の根の汁を吸う(図2A, B)。消化管の前方を取り巻くように共生器官がある(図2C, D)。成虫になると、本来は排出器官であるマルピーギ管のうち2本が発達し、共生器官として機能する(図3A)。共生細菌に特異的なプローブを用いた蛍光in situハイブリダイゼーション法により、幼虫の消化管前部の共生器官と、雌成虫の肥大したマルピーギ管に共生細菌が局在することを確認した(図2E, F;図3B, C)。

図1 キアシネクイハムシの生態(産総研構内)
(A)ガマやヨシが繁茂する生息環境の池。(B)ゼリー状の分泌物に包まれた卵(飼育下)。(C)水草の根に固着する幼虫。(D)タンパク質性の繭を分泌して蛹になる準備をする老熟幼虫。(E)硬化した繭。中に蛹が入っている。(F)ガマ葉上の成虫。
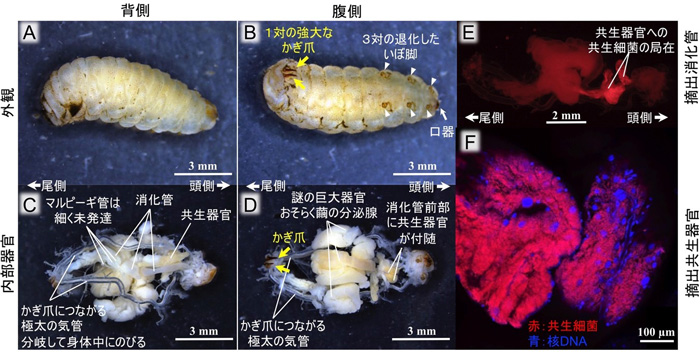
図2 キアシネクイハムシ幼虫の体内構造と共生細菌の局在
(A)外観背側。(B)外観腹側。(C)内部器官背側。かぎ爪の基部から太い気管が全身にのびる。(D)内部器官腹側。消化管前部に共生器官が見える。(E)摘出した消化管における共生細菌の特異的検出。共生器官への局在がわかる。(F)摘出した共生器官における共生細菌とDNAの可視化。赤色が共生細菌、青色が核DNA。
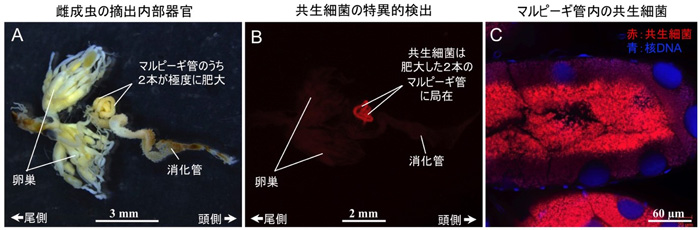
図3 キアシネクイハムシ雌成虫の体内構造と共生細菌の局在
(A)摘出内部器官。マルピーギ管のうち2本が着色、発達している。(B)摘出内部器官における共生細菌の特異的検出。肥大したマルピーギ管に局在する。(C)マルピーギ管内の共生細菌の可視化。赤色が共生細菌、青色が核DNA。細胞内のみならず管腔内にも共生細菌が充満している。
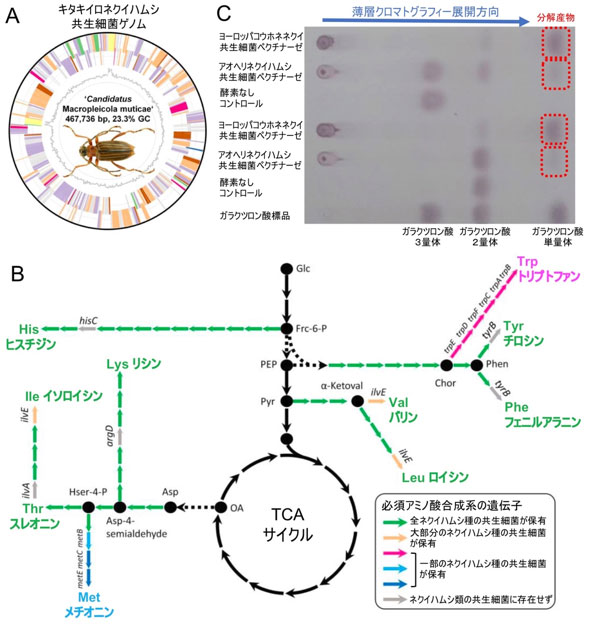
図4 ネクイハムシ共生細菌のゲノム、必須アミノ酸合成系、ペクチン分解酵素
(A)ネクイハムシ共生細菌のゲノム構造。(B)ネクイハムシ共生細菌の必須アミノ酸合成系。(C)ネクイハムシ共生細菌由来のペクチン分解酵素活性の薄層クロマトグラフィーによる検出。
共生細菌のゲノム配列を決定したところ、その大きさは45万〜52万塩基対であり、自由生活性細菌である大腸菌ゲノムの460万塩基対と比べると1/9〜1/10程度に縮小し、細菌の生存に必須な複製、転写、翻訳に関わる以外の代謝系や遺伝子の多くが失われていた(図4A)。例外的によく保存されていたのが、昆虫が自分で作れず、タンパク質合成に必要な必須アミノ酸の合成系遺伝子群であった。今回決定した大部分の共生細菌ゲノムでは、必須アミノ酸の合成系遺伝子と、準必須アミノ酸であるチロシンの合成系遺伝子が保持されていた(図4B)。加えてリボフラビン(ビタミンB2)の合成系遺伝子も保存されていた。このような特徴は、糖類は含まれるがタンパク質に乏しい植物の汁だけを吸って生きているアブラムシ、セミ、ヨコバイなどの共生細菌ゲノムとよく似ており、植物の汁だけを吸って生きるネクイハムシ類の幼虫は、共生細菌が供給する必須アミノ酸を使ってタンパク質合成を行い、成長すると考えられた。
さらに、多くのネクイハムシ類の共生細菌ゲノムには、2種のペクチン分解酵素遺伝子が存在していた。これら共生細菌のペクチン分解酵素は確かに酵素活性を示し(図4C)、一方で宿主昆虫自身はセルロース分解酵素を作るがペクチン分解酵素は持たないことから、ネクイハムシの成虫では細胞壁のセルロースを宿主が、ペクチンを共生細菌が分解することによって葉を消化していると考えられた。なお、ペクチン含量の少ないガマ、ヨシ、スゲなどを食草とするネクイハムシ類の共生細菌ゲノムにはしばしばペクチン分解酵素遺伝子が見つからず、進化の過程で失われたと推定された。
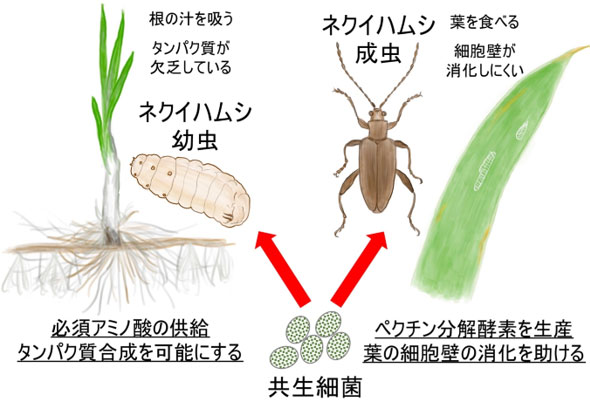
図5 ネクイハムシ幼虫と成虫における共生細菌の異なる機能
これらの結果から、ネクイハムシ類の共生細菌はゲノムが大幅に縮小し、必須アミノ酸などの栄養素合成と、ペクチン分解酵素の生産という、2つの機能に特殊化していることが明らかになった。植物の汁のみを吸う幼虫では欠乏しているタンパク質の合成に必要な必須アミノ酸を、植物の葉を食べる成虫では細胞壁の消化に必要なペクチン分解酵素を、それぞれ共生細菌が供給していると考えられる(図5)。昆虫が幼虫から成虫に変態する過程では、形態のみならず生理や生態も大きく変化する。今回、1種類の共生細菌が同じ宿主昆虫の幼虫と成虫で全く異なる生理機能を担うことが示された。共生進化の過程で多くの遺伝子を失い、ゲノム縮小していくなかで、幼虫および成虫段階それぞれで必須な機能遺伝子が維持されてきたものと推定される。昆虫の変態に伴う暮らし方の変化に共生細菌がどのように関わりうるかを解明した成果であり、共生進化の過程を理解するうえで興味深い。
今回、ネクイハムシ幼虫の体内に巨大な謎の器官を同定した(図2C, D)。おそらく蛹化の際に分泌するタンパク質性の繭(図1D, E)の成分の産生器官と思われる。特殊な新規遺伝子やタンパク質が多量に発現しているものと予想され、その成分の同定と機能解明に取り組みたい。