国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)生物プロセス研究部門【研究部門長 田村 具博】深津 武馬 首席研究員(兼)生物共生進化機構研究グループ 研究グループ長、生物共生進化機構研究グループ 古賀 隆一 主任研究員、福森 香代子 日本学術振興会特別研究員らは、ドイツ マックスプランク研究所、米国 エモリー大学、ドイツ ヨハネスグーテンベルグ大学などと協力して、アザミの葉を食害するアオカメノコハムシの消化管に付随する共生器官中の細胞外共生細菌であるスタメラの全ゲノム配列を決定し、スタメラが植物の細胞壁の主要構成成分の1つであるペクチンを分解する酵素の生産に特化した極めて小さいゲノムをもつことを解明した。アオカメノコハムシの幼虫から共生細菌を除去したところ、体内のペクチン分解酵素の活性が著しく低下し、幼虫の成長や生存が阻害された。植物細胞はセルロース、ヘミセルロース、ペクチンなどの細胞壁多糖類が複合した丈夫な細胞壁で囲まれているが、最も可溶性の高いペクチンを、共生細菌の酵素の助けにより分解して、効率的に植物細胞を破壊して栄養源として利用していると考えられる。
従来、シロアリなどの腸内共生微生物によるセルロース分解が木質の消化に関わることは知られていたが、今回、共生細菌によるペクチン消化が生きた植物組織の利用に重要な役割を果たすことを初めて明らかにした。ハムシ類は多くの農業害虫を含むため、植物消化機構を標的とした新たな害虫防除法の開発につながる可能性も期待される。
この成果は2017年11月16日(現地時間)に米国の学術誌Cellに掲載される。
 |
|
アザミの葉を食べるアオカメノコハムシ |
微生物がもつ高度な物質生産、分解、改変能力は、生態系において重要な役割を果たすだけでなく、人間社会においてもさまざまな形で利用されてきた。特に近年は、腸内細菌が人間の病気や心身の健康に深く関わることも明らかになり、生物体内の細菌、すなわち共生細菌がもつ多様な生物機能が注目されている。
昆虫類も細菌類も著しい多様性を示し、その結果、両者の間には共生関係を含むさまざまな生物間相互作用が見られる。なかでも、木質のように消化分解が難しい餌を利用するシロアリなどでは、体内の細菌や原生生物などの微生物が食物の消化を助けている場合がある。このような共生関係は生態学的に重要であり、また害虫がこのような共生微生物に依存している場合、共生関係の解明が新たな防除技術の開発につながる可能性もある。
産総研では、昆虫体内の共生細菌に注目し、さまざまな新しい生物機能や、宿主と共生細菌間の相互作用を明らかにしてきた。昆虫共生細菌と植物の相互作用については、共生細菌によるアブラムシの植物適応やマルカメムシの害虫化(2004年3月25日、2007年6月13日 産総研プレス発表)、甲虫類の共生細菌については、共生細菌からアズキゾウムシへの遺伝子水平転移の発見や共生細菌によるゾウムシの外骨格の硬化(2002年10月29日、2017年9月19日 産総研プレス発表)などの研究成果がある。
ハムシ類は植物の葉を食べることに特化した甲虫のグループである。世界で約40,000種、日本では約800種が知られ、有名なコロラドハムシや身近なウリハムシをはじめ、多くの農業害虫を含む。しかし、ハムシ類の共生細菌については、1930年代のドイツのスタメル(Hans-Jürgen Stammer)の顕微鏡観察による先駆的な報告以来、ほとんど研究が進んでいなかった。
そこで今回、その実体が未知であったアオカメノコハムシの共生細菌について、微生物学的同定や全ゲノム配列決定を行い、ゲノム情報から推定された共生細菌の生物機能について詳細な解明に取り組んだ。
なお、本研究の一部は、文部科学省 科学研究費補助金の支援を受けて実施した。
アオカメノコハムシを調べたところ、消化管の前方に共生器官があり、その内腔の細胞外に共生細菌が観察された(図1A~C)。各共生器官の内腔はそれぞれ細管で消化管につながっていた(図1B)。さらに雌成虫では、消化管末端部/生殖器官の付近にコイルのような管状の器官(卵へ伝達するために共生細菌を含む物質を分泌する「伝達器官」と思われる)と、消化管末端に共生細菌伝達物質を蓄積する領域(卵へ共生細菌を伝達するための構造である「卵キャップ」を形成するため)があり、その内腔に共生細菌が局在していた(図1A、 D、 E)。卵塊を観察したところ、卵の前端に共生細菌が詰まった卵キャップ(図2A~D)が付着し、幼虫が卵の前端を食い破って孵化するときに、共生細菌の感染が起こるものと考えられた。
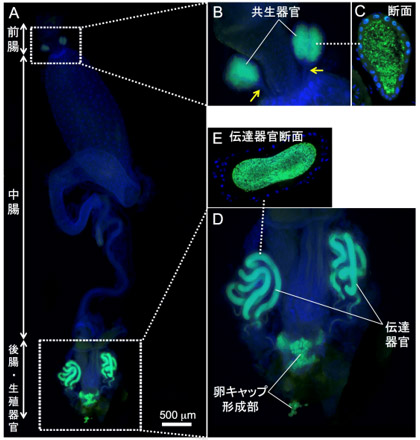 |
図1 アオカメノコハムシの共生器官と共生細菌の局在
(黄色矢印:消化管と連絡する細管、緑:共生細菌、青:DNA)
(A)雌成虫の消化管の全体像。(B)消化管前部の共生器官の拡大像。(C)その内腔に局在する共生細菌。
(D)消化管後部の伝達器官と卵キャップ形成部の拡大像。(E)伝達器官の内腔に局在する共生細菌。 |
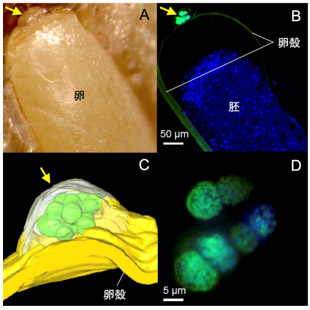 |
図2 アオカメノコハムシの卵での共生細菌の局在
(黄色矢印:卵キャップ、緑:共生細菌、青:DNA)
(A)卵の外観。(B)卵の共焦点蛍光顕微鏡像。共生細菌は卵キャップ内に局在する。
(C) 卵キャップ内の共生細菌局在の模式図。(D) 卵キャップ内の共生細菌塊の拡大像。 |
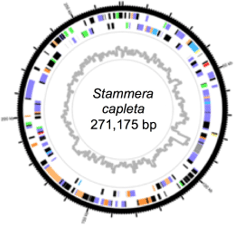
この共生細菌をスタメラ(Stammera capleta)と名付け、アオカメノコハムシ成虫より摘出した共生器官からDNAを抽出し、全ゲノム配列を決定した(図3)。その結果、ゲノムのサイズは約27万塩基対で、既知の細胞外共生細菌の中で最小であり、細菌の生存に必須な複製、転写、翻訳に関わる最小限の遺伝子以外の大部分の代謝系の遺伝子が失われていた。しかし例外的にペクチン分解酵素遺伝子群は残されていて、スタメラはペクチン分解に特化した機能をもつ可能性が示唆された。
 |
|
図3 アオカメノコハムシの共生細菌スタメラのゲノム構造 |
 |
|
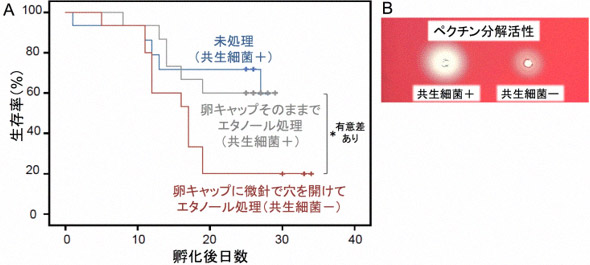
図4 共生細菌の殺菌除去がアオカメノコハムシの生存やペクチン分解酵素活性に与える影響
(A)未処理の卵塊(青)、卵キャップをそのままでエタノール処理した卵塊(灰色)、卵キャップに穴を開けてエタノール処理した卵塊(赤)のそれぞれから孵化した幼虫の生存曲線。 (B)共生細菌の有無による幼虫の消化管磨砕液のペクチン分解活性の違い。 |
未処理の卵塊、卵キャップをそのままでエタノール処理した卵塊、卵キャップに細い針で穴を開けエタノール処理して共生細菌を殺菌した卵塊のそれぞれから幼虫を孵化させて、それらの生存率を調べた。処理が異なっても孵化率は変わらず、エタノール処理自体の卵塊への悪影響はないと考えられた。卵キャップの穴あけと殺菌によって共生細菌の獲得を妨げた幼虫の場合だけ、著しい成長の遅れと生存率の低下を示した(図4A)。また、共生細菌を殺菌除去した幼虫では、消化管でのペクチン分解酵素活性も著しく減少していた(図4B)。
これらの結果から、アオカメノコハムシの細胞外共生細菌スタメラはペクチン分解という単一の生物機能に特化した極小ゲノムを持ち、植食性昆虫である宿主の成長や生存に重要な役割を果たしていることがわかった。植物の細胞はセルロース、ヘミセルロース、ペクチンなどの細胞壁多糖類が複合してできた丈夫な細胞壁に囲まれており、アオカメノコハムシが餌の植物の葉をかみ砕いて飲み込むだけでは、おそらく細胞は十分に壊れない。これらの細胞壁多糖類のうち最も可溶性の高いペクチンを、共生細菌の酵素の助けによって分解することで、効率的に植物細胞を破壊して、内部の栄養豊富な細胞質を栄養源として利用していると考えられる。
アオカメノコハムシ以外にも多種多様なハムシ類において、消化管に付随した共生器官内に共生細菌を保有することが、これまで組織学的に観察、記載されている。これら未探索のハムシ類の共生細菌についても微生物学的実体、多様性、生物機能などについて研究を進めていく。