国立研究開発法人 産業技術総合研究所(以下「産総研」という)生物プロセス研究部門生物共生進化機構研究グループ 古賀 隆一 研究グループ長、森山 実 主任研究員、深津 武馬 首席研究員 兼 ERATO深津共生進化機構プロジェクト 研究総括は、国立大学法人 東京大学 大学院理学系研究科 古澤 力 教授、国立大学法人 東京大学 大学院総合文化研究科 若本 祐一 教授らと共同で、共生細菌なしでは生きられないチャバネアオカメムシから共生細菌を除去し、かわりに高速進化大腸菌を感染させて実験室で継続的に飼育維持することにより、数ヶ月から1年ほどの短期間のうちに、広域転写制御系に生じた単一突然変異により、大腸菌が宿主カメムシの生存を支える必須共生細菌に進化しうることを明らかにした。
本研究により、宿主の生存に必須な共生微生物の進化が、従来考えられていたよりも迅速かつ容易に起こりうることが示された。分子生物学のモデル細菌として最も研究が進んでいる大腸菌を共生細菌に進化させることができたことは画期的である。この昆虫―大腸菌実験共生進化系を用いることにより、今後、共生進化の過程や機構に関する理解が飛躍的に進展することが期待される。
なお、本研究成果は、2022年8月4日(英国夏時間)に国際学術誌「Nature Microbiology」にオンライン掲載される。

共生進化前後の大腸菌およびそれらに感染したチャバネアオカメムシ成虫
進化前の大腸菌は細長く、感染虫の羽化率は低く、体は小型で褐色だが(左)、進化後の大腸菌は短くなり、感染虫の羽化率は改善し、体は大きく緑色になる(右)。
ヒトを含む動植物と微生物の共生関係の研究は、国際的に大きな展開を見せているが、従来の研究はほぼすべて、既存の高度な共生関係を対象にしたものであった。しかし、どんなに高度に特殊化した共生微生物も、もともとは自由生活をしていたはずである。共生関係が具体的にどのように始まり成立したのか、とりわけ宿主生物の生存に必須であるような、高度な相利共生関係の進化的起源は、未解明の本質的な問題である。しかし、遠い過去に起こった進化的事象であるため、実証的な研究は困難であると考えられていた。
一方で近年、主に微生物を対象に、実験室で進化の過程や機構をリアルタイムで明らかにしようという「実験進化学」が盛んに行われている。抗生物質耐性、高温耐性、宿主への感染力や病原性の低下/増強などの進化過程を再現し、理解しようという取り組みである。しかし、宿主生物の生存に必須であるような、高度な相利共生微生物を実験室で進化させることは一般に困難であると考えられており、そのような先行研究は存在しなかった。
産総研生物プロセス研究部門では、陸上生態系における生物多様性の主役である昆虫類、およびそれらの体内に共生して高度な生物機能を担う微生物に着目した研究に取り組んでいる。特に農業害虫として重要なカメムシ類の腸内共生細菌については、「共生細菌による昆虫の害虫化の発見」(2007年6月13日 産総研プレス発表)、「害虫に殺虫剤抵抗性を持たせる共生細菌を発見」(2012年4月24日 産総研プレス発表)、「昆虫と細菌との共生におけるポリエステルの新たな機能」(2013年6月11日 産総研プレス発表)などの研究成果がある。特に、「環境細菌から進化する共生細菌」(2016年1月11日 産総研プレス発表)では、チャバネアオカメムシの日本集団における腸内共生細菌の多様性を解明し、さまざまな共生細菌除去および再感染実験を実施した。そのなかで、大腸菌を含む非共生細菌を用いた感染実験を試みたことが、今回の研究成果に発展する端緒となった。
なお、本研究開発は、国立研究開発法人 科学技術振興機構による「ERATO深津共生進化機構プロジェクト(2019~2024年度)」の支援を受けて行った。
チャバネアオカメムシ(図1A)の消化管の後部は特殊化した共生器官となっており(図1B)、その内部に共生細菌(腸内細菌科Pantoea属の1種)を保有している(図1C)。この共生細菌は幼虫の成長に不可欠で、母虫は卵を産むときに共生細菌を卵の表面に塗布し、孵化した幼虫は卵表面を吸って共生細菌を獲得する(図1D)。共生細菌に感染した幼虫は正常に発育し、飼育条件下では通常80%程度が羽化して緑色の成虫になる(図1A)。一方で、卵表面殺菌により、共生細菌に非感染の幼虫を実験的に作成すると、幼虫は成長が著しく遅れ、ほとんどが成虫になれずに死滅する。
卵表面殺菌した卵から孵化した無菌幼虫に、大腸菌を懸濁した水を吸わせたところ、やはり成長は著しく遅れたものの、ごく少数(5〜10%程度)ではあるが、褐色の異常な体色を呈し、小さい成虫が羽化してきた(図2A)。共生器官は無色で未発達であったが(図2B)、FISH法で確認したところ、大腸菌がその内部に感染しており、共生細菌と同様の局在を呈した(図2C)。これらの成虫の一部は交尾して少数の卵を産んだが、その表面には大腸菌が塗布されており(図2D)、孵化した幼虫は卵表面を吸って大腸菌を獲得した。
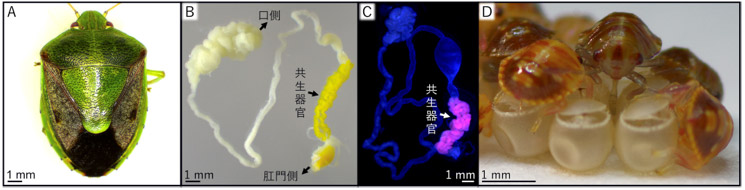
図1 共生細菌に感染した正常なチャバネアオカメムシ
(A)正常な成虫。羽化率は80%程度で緑色である。(B)摘出した消化管。後端部に黄色の共生器官が発達する。(C)FISH法による共生細菌の検出。共生器官に局在している。(D)卵表面に塗布された共生細菌を吸って獲得中の孵化幼虫。
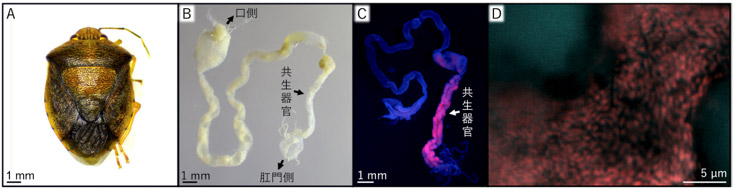
図2 共生細菌を除去してかわりに大腸菌を感染させたチャバネアオカメムシ
(A)羽化した成虫。大部分は幼虫期に死亡し、羽化率は5〜10%程度、体は小さくなり、褐色の異常な体色を呈する。(B)摘出した消化管。後端部の共生器官は無色で細く、未発達である。(C)FISH法による大腸菌の検出。共生細菌と同様に共生器官に局在している。(D)卵表面に塗布された大腸菌の蛍光顕微鏡像。
もともと大腸菌は、主にヒトなど哺乳類の腸内に生息する細菌であり、本来カメムシとは関係がないはずである。それにもかかわらず、不完全ではあるが、カメムシに共生して生存を支える最低限の能力をもつことが判明した。このような大腸菌をカメムシに感染させて、継続的に植えつぐことで共生細菌らしく進化しないだろうか?
大腸菌をカメムシの共生細菌に進化させるため、実験進化学的手法を構想した。ただし、単純に大腸菌をカメムシに感染させて飼育維持しても、大腸菌に共生進化が簡単に起こるとは期待しがたい。そこで、高速進化大腸菌を用いることにした。DNAミスマッチ修復遺伝子mutSを欠失させた大腸菌は、突然変異率が100倍程度に上昇し、分子進化速度が100倍程度に加速する。それに応じて、さまざまな性質の進化速度も加速することが予想される。この高速進化大腸菌を摂取させたカメムシの無菌幼虫を飼育維持することにより、成長速度に選択をかけた(最も早く羽化した成虫の共生器官を摘出して、その中の大腸菌を次世代へ接種/冷凍保存する)実験進化系列、および体色に選択をかけた(最も緑色が強い成虫の共生器官を摘出して、その中の大腸菌を次世代へ接種/冷凍保存する)実験進化系列を作成した(図3)。比較のための対象区としては、進化速度が加速していない野生型の大腸菌に感染させたカメムシについて進化系列を作成した。
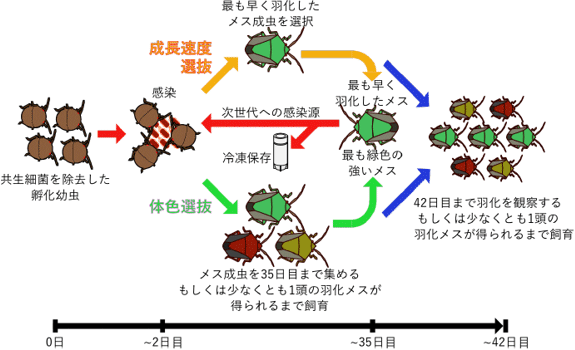
図3 共生進化実験のデザイン
体色選択進化12系列に対象区11系列、成長速度選択7系列に対象区7系列を作成して、約2年間にわたり宿主カメムシの10世代以上にわたる飼育維持を行った。その結果、体色選択進化系列のうち1系列(CmL05)で7世代目(約1年2ヶ月後)から、成長速度選択系列のうち1系列(GmL07)では2世代目(約2ヶ月後)から、羽化率の顕著な上昇(30〜80%)が見られた。これらの進化系列では、羽化率の上昇に伴って、カメムシの体サイズが大きくなり、体色が正常な緑色に近づいていく傾向が見られた(図4上段)。そのような大腸菌をコンゴーレッド含有寒天培地で培養すると、共生進化前は大きく赤色のコロニーを形成したのに対し、共生進化後は小さく白色のコロニーとなり、細胞外基質の産生が顕著に低下していた(図4下段)。

図4 共生進化大腸菌に感染した宿主チャバネアオカメムシの外観および共生進化大腸菌のコロニー形状
宿主カメムシの体サイズ増大および緑色化、大腸菌コロニーの細胞外基質産生の低下が見られた。
また、それらの大腸菌を液体培地で培養して各種性状を調べたところ、増殖速度の低下(図5A)、細胞サイズの小型化(図5B)、べん毛運動性の喪失(図5C)、細胞形態の不安定化(図5D)、宿主体内感染密度の上昇などが観察された。
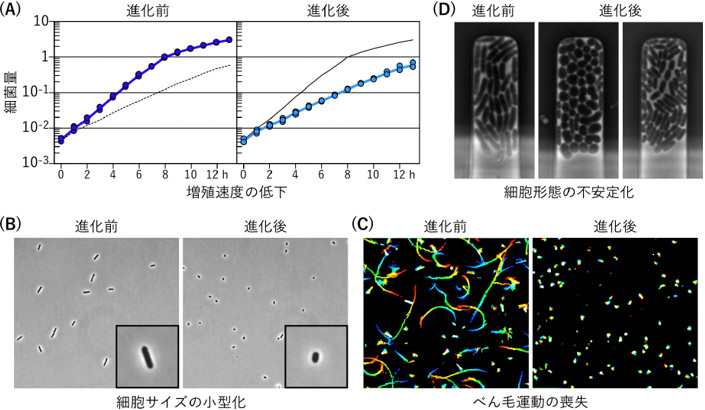
図5 共生進化大腸菌の共生進化前後における変化
独立な進化系列(CmL05, GmL07)における、(A)増殖速度の低下(12時間液体培養における細菌量の増加率)、(B)細胞サイズの小型化(細菌の位相差顕微鏡像)、(C)べん毛運動性の喪失(5秒間の細菌運動軌跡の虹色プロット)、(D)細胞形態の不安定化(もとは桿菌であるが、球菌様の形態や、著しい小型化等を呈する)。
共生進化した進化系列およびしなかった進化系列の大腸菌について、遺伝子発現をRNAseq法により網羅的に調べたところ、共生進化前後で遺伝子発現パターンが顕著に、しかも特定の傾向で変化していた。さらに、両進化系列の大腸菌について、各宿主世代由来の大腸菌の全ゲノム配列を次世代シーケンサーを用いて決定・比較することにより、共生進化に伴って出現したゲノム上の機能喪失突然変異を網羅的に解析した。その結果、候補原因遺伝子として、体色選択進化系列CmL05ではアデニル酸シクラーゼ遺伝子(cyaA)が、成長速度選択進化系列GmL07ではcAMP受容体タンパク質遺伝子(crp)が同定された。これらの遺伝子は、大腸菌その他の細菌類が、周囲にある炭素源(通常は主にグルコース)の枯渇を検知して、他の炭素源(例えばガラクトース、マルトースなど)の利用のために遺伝子発現パターンを大きく切り替える「炭素カタボライト抑制」に関わる広域転写制御系の重要な構成要素である。
これらの遺伝子が大腸菌共生進化の原因遺伝子であるかを確かめるために、野生型の大腸菌のcyaA遺伝子のみ、crp遺伝子のみに同様の突然変異を導入した系統をそれぞれ作成した。するとコロニーは小さく白色になり、細胞サイズの減少、べん毛運動性の喪失などが再現された。さらに、カメムシの無菌幼虫に摂取させたところ、羽化率の向上、体サイズの増大、体色の緑化が再現された(図6)。すなわち、炭素カタボライト抑制が機能しなくなり、グルコース飢餓状態になっても代謝切り替えが起こらなくなるような単一突然変異が生じることにより、大腸菌がカメムシの生存を支える必須共生細菌になることが示された。
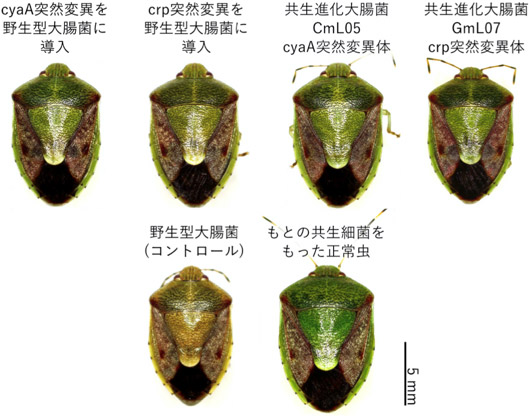
図6 野生型大腸菌への突然変異導入による共生進化原因遺伝子の証明
宿主カメムシの無菌幼虫に摂取させたところ、高い羽化率、体サイズの増大、体色の緑化など、共生進化大腸菌に感染させた宿主カメムシと同様の表現型が観察された。
これらの結果より、大腸菌のゲノムにたった1つの突然変異が入るだけで、チャバネアオカメムシの共生器官内に安定に保持され、生存および繁殖を支える必須共生細菌になりうることがわかった。従来、宿主生物の生存に必須な相利共生細菌の進化は、そう簡単に起こるものではないと考えられていたが、従来の常識を覆し、本研究成果は共生進化が潜在的に迅速かつ容易に起こりうることを示した。ありきたりの細菌である大腸菌がこれほど簡単に相利共生細菌に進化しうるという発見は驚きである。一方で、自然界では多種多様な昆虫類その他の生物が、さまざまな微生物と相利共生関係を結んでいる。微生物との相利共生関係が普遍的かつ多様であるのは、共生進化の成立へのハードルが存外に高くないことを反映しているからではないかと考えられる。従来の進化観に再考をうながし、インパクトを与える知見である。大腸菌は最も研究が進んだモデル生物の1つであり、豊富かつ高度な生物学的情報、遺伝学的リソース、分子生物学的技術が利用可能である。本研究で確立した昆虫―大腸菌実験共生進化系を用いることにより、今後、共生進化の過程や機構に関する理解が飛躍的に進展することが期待される。
炭素カタボライト抑制系が機能しなくなる突然変異により、なぜ大腸菌が共生細菌化しうるのか、その具体的な機構は今後の研究課題である。例えば、今回同定した原因遺伝子の1つであるcrp遺伝子の産物は、cAMPと結合して広域転写制御因子として働き、数百の遺伝子の発現を増減させることにより、代謝切り替えを引き起こす。それら多数の下流遺伝子のうち、どれが共生細菌化に関与するのか、大腸菌の突然変異体ライブラリーをカメムシの無菌幼虫に摂取させてスクリーニングするなどの方法によって探索を進める。
大腸菌の共生細菌化に関わる遺伝子は他にもさまざまなものがあると予想される。私たちはすでに、カメムシの羽化率を顕著に改善するが、コロニー形状の変化が見られないような共生進化大腸菌系統を複数取得しており、それらの機能解析を進めるとともに、より大規模に昆虫―大腸菌共生進化実験を継続していく。
大腸菌はもともとヒトやマウスなど哺乳類の腸内細菌である。近年は、無菌マウスに大腸菌を摂取させて作成したノトバイオートマウスを用いた実験進化学的研究も盛んに行われている。すでに昆虫―大腸菌実験共生進化系とマウス―大腸菌実験共生進化系を組み合わせた進化実験に着手しており、そのようなアプローチから無脊椎動物と脊椎動物の間の腸内共生機構の相違点および共通点を追求していく予定である。
掲載誌:Nature Microbiology
論文タイトル:Single mutation makes Escherichia coli an insect mutualist
著者:Ryuichi Koga, Minoru Moriyama, Naoko Onodera-Tanifuji, Yoshiko Ishii, Hiroki Takai, Masaki Mizutani, Kohei Oguchi, Reiko Okura, Shingo Suzuki, Yasuhiro Goto, Tetsuya Hayashi, Masahide Seki, Yutaka Suzuki, Yudai Nishide, Takahiro Hosokawa, Yuichi Wakamoto, Chikara Furusawa, Takema Fukatsu
DOI:10.1038/s41564-022-01179-9