国立研究開発法人 産業技術総合研究所(以下「産総研」という)生物プロセス研究部門生物共生進化機構研究グループ 二橋 亮 主任研究員、森山 実 主任研究員、深津 武馬 首席研究員(東京大学大学院理学系研究科 教授(兼任))は、東京大学大学院理学系研究科生物科学専攻博士後期課程(当時)の奥出 絃太 元産総研技術研修員(現 国立遺伝学研究所生態遺伝学研究室 日本学術振興会特別研究員)、学校法人 東京農業大学(以下「東京農大」という)生命科学部 矢嶋 俊介 教授、生物資源ゲノム解析センター 川原(三木) 玲香 元博士研究員と共同で、トンボが幼虫から成虫への変態に必要な遺伝子群を解析し、重要な3種類の転写因子を同定した。その中の一つで他の昆虫の「さなぎ」の形質を決定する転写因子が、さなぎの時期を持たないトンボでは、幼虫の形質を作り出す遺伝子と成虫の形質を作り出す遺伝子の両方をコントロールしていることを発見した。これは、昆虫の多様性を担う変態を解明する重要な成果である。
なお、この研究成果は、2022年2月21日(米国東部時間)の週に米国の学術誌「Proceedings of the National Academy of Sciences of the United States of America」(米国科学アカデミー紀要)にオンライン掲載される。
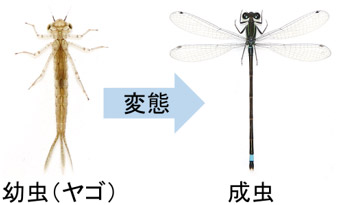
アオモンイトトンボの幼虫(ヤゴ)と成虫:変態によって形質が大きく変化する
昆虫類は、生物種の過半数を占める。ほとんどの昆虫類は、幼虫から成虫に移行する「変態」により、形態や行動が変化する。「変態」によって、さまざまな環境や食物に適応できることが、昆虫類の繁栄の大きな要因と考えられている。また、昆虫類に特異的な変態に関わる分子は、人畜に害の少ない昆虫成長制御剤の標的となるなど農薬開発の手がかりとなるため、害虫防除の観点からも着目されてきた。
昆虫類の変態に関する分子機構は、ショウジョウバエやカイコなど幼虫と成虫の間に「さなぎ」の時期を持つ完全変態昆虫を中心に研究されてきた。一方で、「さなぎ」の時期を持たないバッタやゴキブリなどの昆虫類は、不完全変態昆虫として知られる。トンボは、不完全変態昆虫の中でも、「さなぎ」の時期を経ずに幼虫(ヤゴ)から成虫へと形態や生態が劇的に変化するが、変態に関わる具体的な遺伝子は未解明であった。
産総研生物プロセス研究部門では、さまざまな昆虫類を対象に高度な生物機能の解明に取り組み、生態的に重要な機能を持つ昆虫の体色形成(2010年11月19日、2012年7月10日、2015年2月24日、2019年1月15日 産総研プレス発表)や、昆虫の変態に伴う共生細菌の役割の変化(2020年6月11日 産総研プレス発表)に関して成果をあげてきた。東京農大では、「文部科学省特色ある共同研究拠点 生物資源ゲノム解析拠点」として、次世代シーケンサーを用いた生物の遺伝子解析に実績がある。本研究では、水中生活を行う地味な体色の幼虫(ヤゴ)から、陸上生活を行う色鮮やかな成虫へと、劇的に形態を変化させるトンボに着目して、その変態に重要な遺伝子群の同定に取り組んだ。なお、本研究の一部は、文部科学省および日本学術振興会の科学研究費助成事業 特別研究員奨励費(JP18J21561)、新学術領域研究(18H04893、JP20H04936)、基盤研究B(JP18H02491、JP19H03287)の支援を受けて実施した。
トンボは、幼虫(ヤゴ)の間は暗い体色で水中生活を送るのに対し、成虫に変態すると発達した視覚を用いて活発に空中を飛び回り、雌雄で体色が大きく異なる種も多い。しかし、幼虫や成虫の形質に関わる具体的な遺伝子は未解明であった。イトトンボの一種であるアオモンイトトンボ(図1)を用いて、さまざまな発生段階の体の各部位における遺伝子発現を、次世代シーケンサーで網羅的に解析した。その結果、幼虫の時期にのみ全身で発現する8種類の遺伝子と成虫の時期にのみ全身で発現する7種類の遺伝子が得られた。

図1. 実験に用いたアオモンイトトンボとコシアキトンボ
白い矢じりは幼虫の抜け殻(羽化殻)を示す。
これら15種類の遺伝子について、アオモンイトトンボの腹部表皮を対象に局所的RNAi法を用いて、遺伝子の機能阻害を実施し、幼虫や成虫の形質の変化の有無を解析した。その結果、アオモンイトトンボとコシアキトンボの2種に共通して、Kr-h1遺伝子、E93遺伝子、broad遺伝子の3種類の転写因子の機能阻害によって、変態に伴うものとは異なる表現型が明らかになった。
Kr-h1遺伝子は、多くの昆虫で幼虫形質の維持に関与する転写因子で、トンボでは卵から幼虫にかけて発現するが、終齢幼虫(次の脱皮で成虫になる幼虫)になると発現しなかった。Kr-h1遺伝子の機能を局所的に阻害した幼虫では、その部分に成虫様の体色と表面構造が作られ、成虫化することが確認された(図2)。
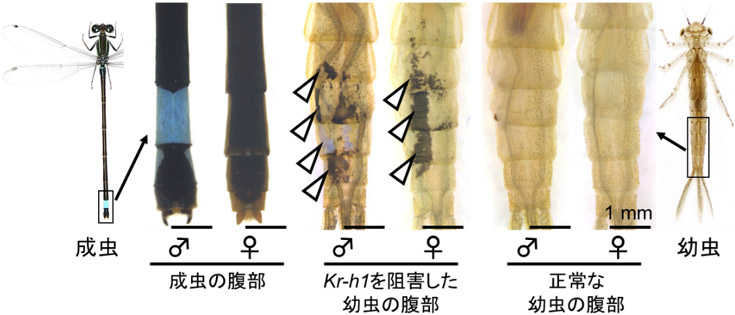
図2. アオモンイトトンボにおけるKr-h1遺伝子の機能解析
遺伝子の発現を腹部の一部で抑制した。
白い矢じりはKr-h1遺伝子を局所的に抑制した幼虫に現れた成虫様の体色を示す。
E93遺伝子は、多くの昆虫で成虫形質の形成に重要な転写因子であり、トンボでは終齢幼虫の途中から発現することが確認された。E93遺伝子の機能を局所的に阻害した成虫では、Kr-h1遺伝子とは逆にその部分に幼虫様の体色と表面構造が見られ、E93遺伝子は成虫化に必須であることが明らかになった(図3)。
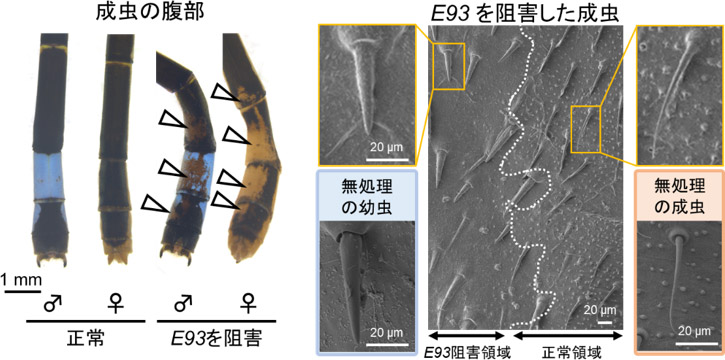
図3. アオモンイトトンボにおけるE93遺伝子の機能解析
白い矢じりはE93遺伝子を局所的に抑制した成虫に見られた幼虫様の領域を示す。
幼虫様領域と正常領域の境界部の表面構造を走査電子顕微鏡で観察した。
broad遺伝子は、さなぎの時期を持つ完全変態昆虫では、さなぎの形質を決定する転写因子として機能すること、一方でさなぎの時期を持たないコオロギ(バッタ目)やゴキブリ(ゴキブリ目)では、成虫の翅や産卵管の発達に関与することが知られていた。トンボのbroad遺伝子は、卵から終齢幼虫の前半にかけて発現が確認された。broad遺伝子の機能を局所的に阻害した幼虫では、灰色の着色が見られたが、Kr-h1遺伝子とは異なり雌雄差は見られず、幼虫と類似した表面構造を持つことからも成虫の形質と同一ではないと考えられた(図4)。
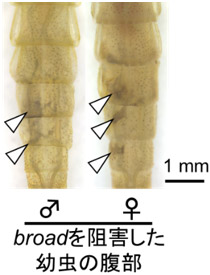
図4. アオモンイトトンボにおけるbroad遺伝子の解析
白い矢じりはbroad遺伝子を局所的に抑制した幼虫に現れた灰色の着色を示す。
Kr-h1遺伝子、E93遺伝子、broad遺伝子は、いずれも転写因子として働くため、幼虫や成虫に特徴的な形質(表皮の形成や色素合成など)に直接関わる遺伝子の働きをコントロールすることが予想された。この点を詳細に解明するため、アオモンイトトンボ幼虫表皮のRNAi領域と未処理領域から別々にRNAを抽出して、網羅的な遺伝子発現解析を行い、Kr-h1遺伝子、broad遺伝子、E93遺伝子の3種類の転写因子によって制御される遺伝子を多数同定した。その中には、成虫の鮮やかな体色形成に関与することが予想される色素合成遺伝子や、幼虫と成虫で異なる体表構造の形成に関与することが予想されるクチクラタンパク質遺伝子が多数含まれていた。また、Kr-h1遺伝子のRNAiによってKr-h1遺伝子の発現を阻害した領域では、全体的に幼虫の時期に表皮で働く遺伝子(幼虫表皮特異的遺伝子)が阻害されると同時に成虫になると表皮で働く遺伝子(成虫表皮特異的遺伝子)が活性化するという遺伝子発現パターンの成虫化が確認された。一方、終齢幼虫におけるbroad遺伝子のRNAi領域では、成虫表皮特異的遺伝子の中で発現が誘導されるものが確認され(Kr-h1遺伝子のRNAi領域と比較すると発現が誘導される遺伝子数は少ない)、幼虫表皮特異的遺伝子の中で発現が阻害されるものが確認された(Kr-h1遺伝子のRNAi領域と比較すると発現が阻害される遺伝子数は少ない)。このように、broad遺伝子の機能阻害によって、部分的な遺伝子発現パターンの成虫化が認められた(図5)。
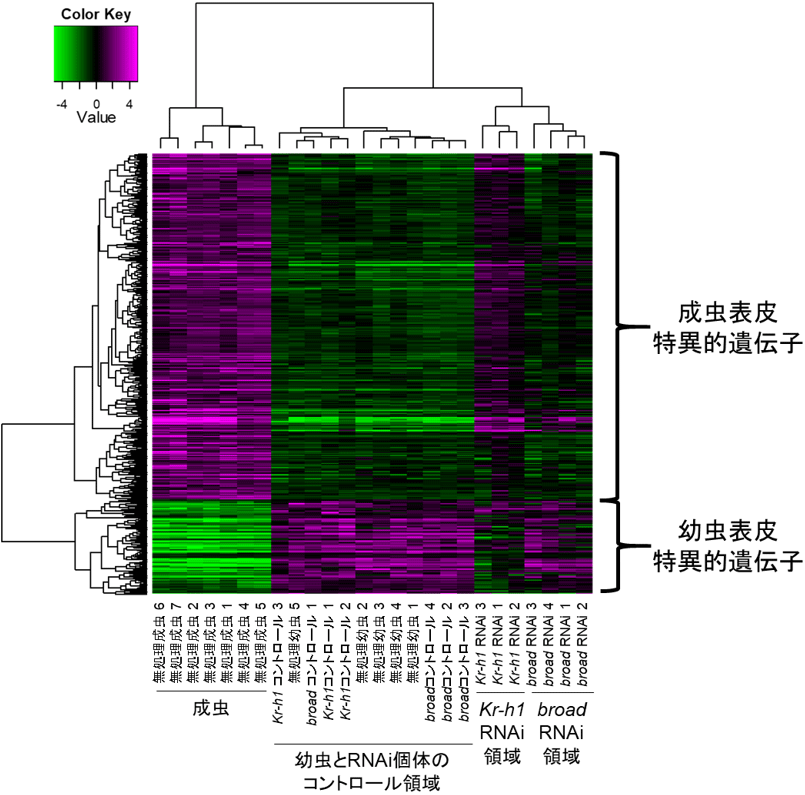
図5. アオモンイトトンボにおけるKr-h1遺伝子およびbroad遺伝子の機能阻害を行った際の遺伝子発現パターンの変化
無処理の幼虫表皮および成虫表皮の遺伝子発現と比較した。
マゼンタは発現量の高い遺伝子、緑色は発現量の低い遺伝子を表す。
トンボの発生過程におけるKr-h1遺伝子、E93遺伝子、broad遺伝子の役割を図6にまとめた。幼虫の間はKr-h1遺伝子が幼虫形質の維持に関わり、成虫化の際にE93遺伝子が重要である点は、トンボも他の昆虫と基本的に似ているが、これら2種の遺伝子の働きが切り替わる終齢幼虫の時期にbroad 遺伝子が幼虫形質と成虫形質の両方を部分的に制御する点は、他の昆虫では報告されていない新知見である。
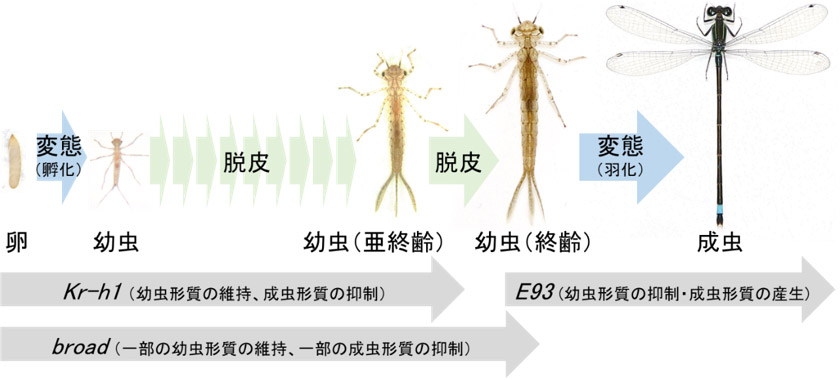
図6. トンボの発生過程におけるKr-h1遺伝子、E93遺伝子、broad遺伝子の役割のまとめ
他の昆虫では、Kr-h1遺伝子、E93遺伝子、broad遺伝子の3種類の転写因子は、お互いの遺伝子を調節し合うことが知られている(図7)。トンボにおけるこれらの遺伝子の制御関係を詳細に解析した結果、Kr-h1遺伝子はE93遺伝子を抑制しており、Kr-h1遺伝子のRNAi領域では、E93遺伝子が早期に発現するために成虫化することを確認した。また、さなぎの時期がないトンボでは、図7に赤で示したようにbroad遺伝子の役割が他の昆虫とは異なっており、幼虫形質に関わる遺伝子と成虫形質に関わる遺伝子の両方の制御に重要であることを明らかにした(図7)。
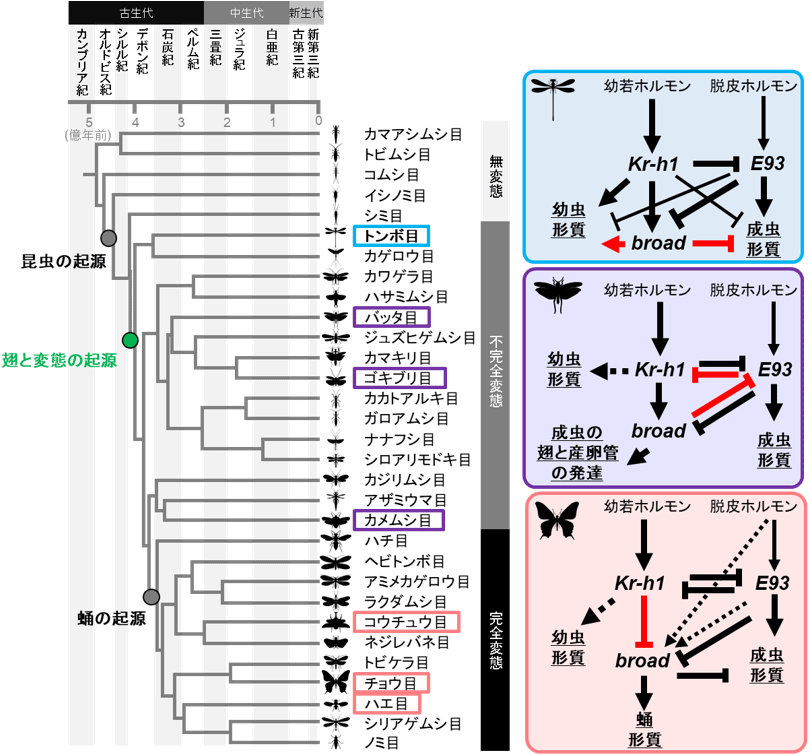
図7. 昆虫の進化過程における3種類の転写因子(Kr-h1、broad、E93)の役割の変化
進化の過程で遺伝子間の制御関係が変化した部分を赤で示した。
→は発現を誘導すること、⊣は発現を抑制することを示す。
今回、およそ4億年前に他の昆虫から分岐したトンボにおいて、幼虫から成虫への変態に必須な遺伝子群の同定に成功した。また、変態の制御に重要な3種類の転写因子が、トンボでは他の昆虫とは異なる調節関係にあることを発見した。これは昆虫の変態を制御する分子機構に関する新知見であり、完全変態昆虫でさなぎの形質を規定するbroad遺伝子の機能が、昆虫間でどのように進化してきたかを理解する上で重要な発見である。
昆虫の変態に関与する因子は、昆虫成長制御剤の開発につながる。そのため、変態に関する分子基盤の多様性の解明は、特定の昆虫に有効な農薬の開発につながる可能性がある。一方で、Kr-h1遺伝子、broad遺伝子、E93遺伝子の3種類の転写因子によって制御される遺伝子の具体的な役割や、それぞれの遺伝子が昆虫間でどの程度保存されているかは不明な点が多い。今後は、本研究で得られたKr-h1、broad、E93の3種類の遺伝子によって制御される遺伝子群を標的に、網羅的な遺伝子機能阻害実験を実施し、幼虫と成虫の形態を生み出す分子機構の詳細な解明にさらに取り組む。
掲載誌:Proceedings of the National Academy of Sciences of the United States of America
論文タイトル:Molecular mechanisms underlying metamorphosis in the most ancestral winged insect
著者:Genta Okude, Minoru Moriyama, Ryouka Kawahara-Miki, Shunsuke Yajima, Takema Fukatsu, Ryo Futahashi