国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)ナノ材料研究部門【研究部門長 佐々木 毅】都 英次郎 主任研究員らは、バイオメディカル研究部門【研究部門長 近江谷 克裕】戸井 基道 研究グループ長、公立大学法人 大阪府立大学【理事長・学長 辻 洋】大学院工学研究科 河野 健司 教授らと協力して、光によって発熱できるカーボンナノチューブ(CNT)と特定の温度で内包分子を放出する温度感受性リポソームを組み合わせて、線虫Caenorhabditis elegans体内の細胞機能を制御できる分子複合体(ナノロボット)を開発した。
今回の開発により、生体内の細胞表面上にある特定のタンパク質を遠隔制御することができる。また、分子・細胞レベルでの病態メカニズムの解明や新たな治療法を開発するためのツールとしても期待される。
なお、この研究の詳細は、ドイツの化学誌Angewandte Chemie International Editionに2015年7月4日(日本時間)にオンライン掲載された。
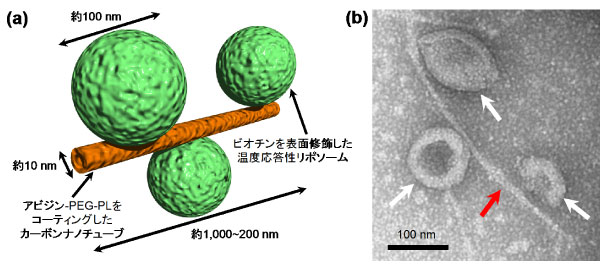 |
(a) CNTとリポソームからなるナノロボットの概念図と(b)ナノロボットの電子顕微鏡写真
白い矢印はリポソーム、赤い矢印はCNTを示す
|
分子の大きさの世界であるナノメートルスケール(1 nmは10億分の1 m)で、分子を思いどおりに並べて動かすナノテクノロジーは、科学・技術全般における重要なテーマの一つである。近年、規則的に集合、組織化した分子により高度な機能をもつナノロボットに大きな注目が集まっている。特に、生体環境下で高度に機能する革新的なナノロボットは、がんや免疫疾患といった医療分野において、早期の実現が求められている。
産総研では、近赤外レーザー光により容易に発熱するナノカーボン材料の特性(光発熱特性)に注目し、これまでに、体の中で発電できる光熱発電素子(2011年10月27日 産総研プレス発表)、生体内で標的とする生理活性物質を生み出す遺伝子発現制御技術(2012年4月24日 産総研プレス発表)、生体機能を模倣した新しい分子伝送システム(2012年11月28日 産総研プレス発表)、生きた細胞を光エネルギーで制御する技術(2014年10月27日 産総研プレス発表)などを開発している。今回、CNTとリポソームを分子レベルで組み合わせ、細胞機能を制御できる分子複合体の開発に取り組んだ。
今回の研究開発は、独立行政法人 日本学術振興会の科学研究費助成事業「挑戦的萌芽研究(平成27年度)」及び「若手研究(A)(平成25~27年度)」、公益財団法人 新世代研究所の2014年度研究助成による支援を受けて行った。
CNTは、そのまま水中に分散させようとすると、強い分子間の相互作用により束状や粒状に凝集してしまう。産総研ではCNTの用途に応じた分散性向上のための研究開発が行われているが、本研究では、CNTの光発熱特性を最大限に利用し、かつ、リポソームと組み合わせて分子複合体を作製するために、アビジン、ポリエチレングリコール(PEG)、リン脂質(PL)からなる分子(アビジン-PEG-PL)を単層CNT(SWCNT)の表面にコーティングし、水中へ分散させた。一方、リポソームには、温度感受性(42 ℃付近で構造変化)を与えるため、各種リン脂質とコレステロールの配合量を調整のうえ、アビジンと強く結合できるビオチンを表面に結合させた。そして、アビジンとビオチンの結合を利用した自己組織化により、CNTとリポソームからなる分子複合体を作製した(概念図)。この分子複合体はナノスケールのロボットに例えられる「ナノロボット」に相当し、近赤外領域の光エネルギーを与えると内包している分子(薬物など)を放出し、この薬物により細胞機能を制御できる。
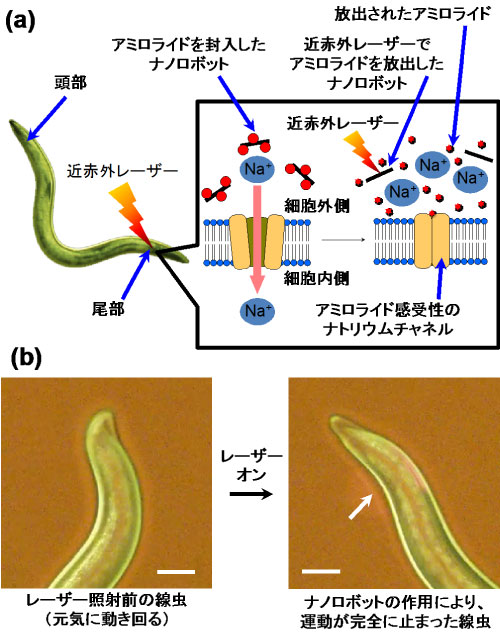 |
図1 ナノロボットによる細胞機能制御の概念図(a)と線虫の運動抑制効果(b)
スケールバー:50 μm |
およそ1000個の細胞からなる線虫を用いて、今回開発したCNTとリポソームの複合分子体であるナノロボットの運動抑制効果を検証した(図1(a))。温度感受性リポソームに、ナトリウムチャネル阻害剤であるアミロライドを内包させたナノロボットを水溶液に分散させ、線虫の体内にマイクロインジェクターを用いて注入した。近赤外レーザー光(波長808 nm)をアミロライド感受性のナトリウムチャネルが存在する尾部に照射したところ、素早く動いていた線虫の動きが徐々に遅くなり、最終的には動きを完全に止めた(図1(b))。これは、近赤外レーザー光を照射すると、CNTの光発熱特性によって、CNT近くの温度が急激に上昇して温度感受性リポソームの構造が変化し、内部のアミロライドが放出され、線虫のアミロライド感受性チャネルタンパク質が阻害されたと考えられる。なお、アミロライドを内包した温度感受性リポソームだけを注入した場合は、近赤外レーザーを照射しても、アミロライドの放出や線虫の運動障害が起こらなかった。
 |
|
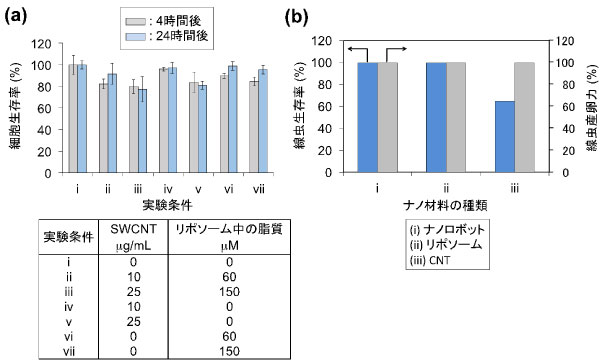
図2ナノロボットの細胞毒性(a)と生体適合性(b) |
次に、ヒト子宮頸部類上皮がん細胞(HeLa細胞)と線虫を用いて、今回開発したナノロボットの細胞毒性と生体適合性を評価した。まず、ナノロボット、CNT、リポソームのそれぞれを分散させた3種の培養液をHeLa細胞に投与し、WST-1法により4時間後と24時間後に生きているHeLa細胞の割合を測定した(図2(a))。この結果、いずれの場合も投与による細胞生存率の低下は見られなかった。また、これらの物質を線虫体内に投与し、線虫のライフサイクルにあたる5日間にわたって生体適合性評価(生死判定、産卵力判定)を行ったところ、いずれの検査でもナノロボットとリポソームが線虫に与える影響は極めて少なかった(図2(b))。なお、CNTを単体で線虫体内に投与した場合には、線虫生存率が60 %となったが、これは線虫体内でCNTが異物とみなされる通常の生体応答と考えられ、CNTの表面に結合したリポソームが生体適合性をさらに向上させることが明らかとなった。
今後は、この技術を応用して、生体組織のごく限られた領域だけに存在する細胞機能を個々に調べることで、がんや免疫疾患などの分子・細胞レベルでの病態解明につながる研究用ツールを開発したい。一方で、生体内におけるナノ物質の健康面への影響は不明瞭な点もあるため、CNTを用いて作製する様々な物質の細胞毒性評価や生体適合性評価を進めて、生体内で安心・安全に利用できる材料やシステムの開発を目指す。