独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)健康工学研究部門【研究部門長 吉田 康一】ストレスシグナル研究グループ【研究グループ長 萩原 義久】都 英次郎 研究員らは、産総研 ナノチューブ応用研究センター【研究センター長 飯島 澄男】および国立大学法人 京都大学【総長 松本 紘】大学院薬学研究科【研究科長 佐治 英郎】と協力して、光によって容易に発熱できるカーボンナノホーン(CNH)の特性(光発熱特性)を利用して、生体内で標的とする生理活性物質を生み出す新しい遺伝子発現制御技術を開発した。
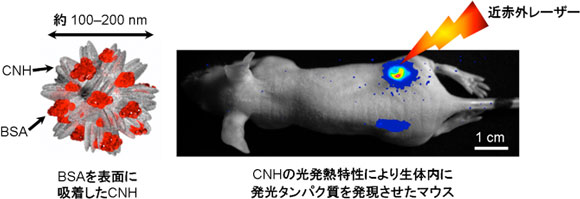
ナノ炭素材料の一つであるCNHは、とりわけバイオメディカル分野で大きな注目を集めている。今回、CNH表面に親水性タンパク質である牛血清アルブミン(BSA)を吸着させたBSA-CNH複合体を作製した。このBSA-CNH複合体を分散させた水溶液に、生体透過性の高い近赤外領域のレーザー光を照射すると効果的に発熱できる。この光発熱システムを熱に反応(熱ショック応答)して遺伝子が発現する形質転換細胞に適用することで、目的とする機能性分子(蛍光タンパク質や発光タンパク質)をマウス生体内で合成できる細胞機能を生体外から遠隔制御できる新たな技術を開発した。今回開発した技術によって、ナノ材料の光発熱特性を利用した、これまでにない概念の細胞療法(細胞を用いる治療法)を実現できる。この技術は、分子・細胞レベルでの病態の解明につながる研究の強力なツールとしても期待される。
なお、この技術の詳細は、米国科学アカデミー紀要(Proceedings of the National Academy of Sciences USA, PNAS)に2012年4月24日(日本時間)にオンライン掲載される。
 |
|
CNHの光発熱特性を利用した遺伝子発現制御技術 |
細胞療法は、がん、免疫疾患、内分泌・代謝疾患、血友病、骨疾患などのさまざまな病気の予防・治療に効果を発揮する。細胞機能を自在に制御できれば、より効果的な治療法の確立が期待できる。一方、ほとんどの細胞は熱ショックに応答して遺伝子発現のスイッチを活性化状態にする遺伝子配列を持つことが知られている。また、この熱ショック応答性の遺伝子配列にタンパク質やペプチドなどの機能性分子に対応した遺伝子を結合させれば、加熱により目的とする機能性分子を産生できる。近年、レーザー光を照射することで熱ショックを与え、それに対する応答を利用して細胞の遺伝子発現を制御しようとする技術に注目が集まっている。しかし、これまで報告されている方法は、生体透過性の低い紫外、可視、赤外光を使用するものであり、正常な細胞や遺伝子に損傷を与える恐れがあるなど応用上の制約があった。
CNHは生体透過性の高い波長領域(650~1100 nm)のレーザー光により容易に発熱する。これを熱ショックに応答して遺伝子を発現する形質転換細胞に適用して、生理活性物質を生体内で合成させる細胞機能の新たな遠隔制御技術の開発に取り組んだ。
なお、本研究開発の一部は、公益財団法人 国際科学技術財団の2012年研究助成および独立行政法人 日本学術振興会の科学研究費補助金「若手研究(B)(平成23~24年度)」による支援を受けて行ったものである。
また、本研究開発で行った組換えDNA実験ならびに動物実験については、動物愛護管理法を遵守するなど、適切な方法により実施した。具体的には、実験計画を産総研ならびに京都大学の組換えDNA実験委員会および動物実験委員会に申請し、承認を受けてから実験を行った。
CNHは、そのまま水などに分散させようとすると、分子間の強い相互作用により、粒状に凝集してしまう。CNHに高い光発熱特性を発揮させるためには、この凝集状態を解消しCNHを溶媒中にナノレベルで分散させる必要がある。今回開発した技術では、親水性タンパク質であるBSAをCNH表面に吸着させることで、細胞培養液中に分散できるようにした。図1に、BSA-CNH複合体の培養液中への分散性と光発熱特性を評価した結果を示す。培養液中でのBSA-CNH複合体の分散安定性は高く、4 ℃で1週間放置してもCNHの凝集体は形成されなかった(図1a)。また、BSA-CNHを分散させた培養液にレーザー光(波長670 nm)を照射するとCNHの強力な光発熱特性によりレーザー出力に応じた温度上昇が観察された(図1b)。なお、培養液中にBSA-CNHが含まれない場合、レーザー光をあてても温度は上昇しなかった。
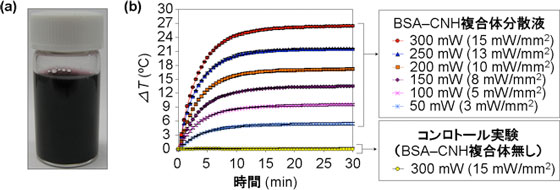 |
図1 BSA-CNH複合体分散培養液の光発熱特性
a:4 ℃で1週間放置したBSA-CNH複合体分散培養液
b:波長670 nmのレーザー光を照射したときの温度経時変化 |
次に、熱ショック応答遺伝子に蛍光タンパク質遺伝子を導入した3種類の形質転換細胞[マウス繊維芽細胞(NIH 3T3)、マウス大腸がん細胞(Colon-26)、ラットC6グリオーマ細胞(C6)]に、BSA-CNH複合体を投与し、レーザー光(波長670 nmあるいは785 nm)を照射して、遺伝子発現効果を検証した(図2a)。この結果、これらの細胞へのレーザー光照射によって効果的に蛍光タンパク質[緑色蛍光タンパク質(GFP)、赤色蛍光タンパク質(DsRed)]が発現することがわかった。また、BSA-CNH複合体と形質転換させたNIH 3T3細胞[熱ショック応答遺伝子に発光タンパク質(ルシフェラーゼ)遺伝子を導入]からなる培地分散液をマウスの背中に埋め込みレーザー光(波長785 nm)を照射したところ、生体内においてもCNHの光発熱特性によって効果的に遺伝子発現が起こることがわかった(図2b)。また、レーザー光照射によって体表面が42 ℃になるように設定したマウスが最もルシフェラーゼを発現していた。
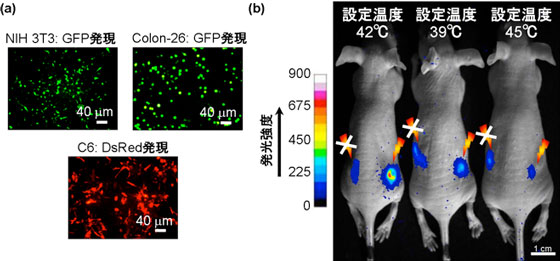 |
図2 CNHの光発熱特性を活用した遺伝子発現制御
a: さまざまな形質転換細胞の蛍光タンパク質発現挙動
b: 生体内におけるルシフェラーゼ発現挙動(レーザー照射はマウス背中の右側のみ) |
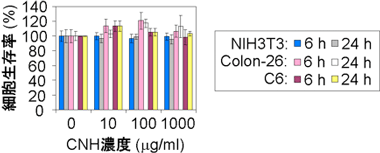
最後に、BSA-CNH複合体の細胞毒性と生体適合性を評価した。3種類の細胞(NIH3T3、Colon-26、C6)を用いて、BSA-CNHを分散させた培養液を細胞に投与し、6時間後および24時間後にWST-1法により、ミトコンドリア活性を指標として細胞生存率を測定した(図3)。この結果、BSA-CNH投与による細胞生存率の低下は見られなかった。また、BSA-CNH分散液(100 µg/mL)をマウスの背中に投与後、およそ1ヶ月にわたって生体適合性評価(体重測定、血液検査、病理組織解析)を行ったところ、いずれの検査からもBSA-CNHが生体に与える影響は極めて少ないことがわかった。
 |
|
図3 WST-1法によるBSA-CNHの細胞毒性評価 |
今回開発した技術は、CNHの光発熱特性によって生体内での生理活性物質の発現を時間的・空間的に制御できるため、例えば、がん細胞に絞ってレーザー光を照射して、遺伝子を発現させることで、無関係な細胞を傷つけることなくがん細胞のみを殺すなど、既存の細胞療法技術の性能を飛躍的に向上できる可能性がある。今後は、この技術を応用して、さまざまな細胞療法へと展開していきたい。また、生体組織のごく限られた領域だけにある細胞で働く遺伝子の機能を個々に調べることで、がんや免疫疾患の分子・細胞レベルでの病態の解明につながる研究用ツールを開発したい。一方で生体内におけるナノ物質の健康面への影響は未だ不明であるため、CNHそのものの細胞毒性評価および生体適合性評価を積極的に進めることで、生体内で安心・安全に利用できる材料やシステムの開発を目指す。