独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)健康工学研究部門【研究部門長 吉田 康一】ストレスシグナル研究グループ 都 英次郎 研究員らは、公立大学法人 大阪府立大学【理事長・学長 奥野 武俊】大学院工学研究科【研究科長 池田 良穂】河野 健司 教授らと協力して、光によって発熱可能なカーボンナノチューブ(CNT)と特定の温度で内包分子を放出する温度感受性リポソームを組み合せて、電圧をかけることによって目的位置まで正確に分子を運び、レーザー光照射によって分子を放出できる分子複合体(ナノ電車)を開発した。また、開発したナノ電車を用いると、酵素反応の開始を遠隔制御できる。
今回の開発により、病気の発生・進行を未然に防ぐ予防医療のための高性能なマイクロ流体デバイスの開発に貢献することが期待される。
なお、この技術の詳細は、英国の科学誌Nature Communicationsに2012年11月28日(日本時間)にオンライン掲載される。
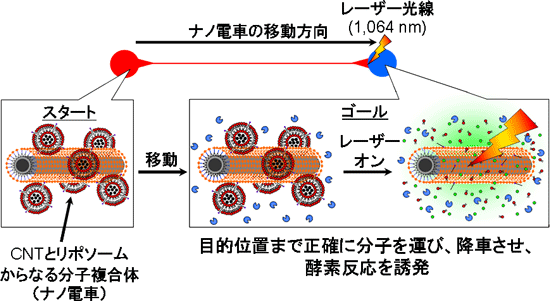 |
| CNTとリポソームを複合したナノ電車による分子伝送システム |
人間をはじめとする多細胞生物は、個々の細胞間でホルモンなどのシグナル伝達分子を授受することで、恒常性の維持や成長の調節、運動制御や記憶・学習などさまざまな生命活動を行っている。このような生体機能からヒントを得て、DNAやタンパク質などの分子を伝達し、目的とする化学・生化学反応を誘発する分子伝送システムが開発できれば、化学、医療などのさまざまな分野での革新的な応用につながる。これまでにもこのような分子伝送システムの研究が行われてきたが、分子伝送システムをより効果的に機能させるためには、次の3点の主要技術の開発が立ち遅れている。(1) 出発点から送出された分子を目的の場所まで伝送する指向性をもった分子伝送技術、(2) 目的の場所で分子を位置選択的に放出させる技術。(3) 目的の場所で目的の化学・生化学反応を誘発させる技術。そのため、これらの技術開発が求められている。
産総研では、レーザー光により容易に発熱するCNTの光発熱特性に注目し、これまでに、体の中で発電できる光熱発電素子(2011年10月27日 産総研プレス発表)や生体内で標的とする生理活性物質を生み出す遺伝子発現制御技術(2012年4月24日 産総研プレス発表)を開発している。今回、光発熱特性をもつCNTを、特定の温度で内包する分子を放出できる温度感受性リポソームと組み合せることで、生体機能を模倣した新しい分子伝送システムの開発に取り組んだ。
この研究開発の一部は、公益財団法人 花王芸術・科学財団の平成24年度科学技術研究助成、公益財団法人 国際科学技術財団の2012 年研究助成、独立行政法人 日本学術振興会の科学研究費補助金「若手研究(B)(平成23~25年度)」による支援を受けて行った。
CNTとリポソームからなる生体機能を模倣した高性能な分子伝送システムを開発した(図1(a))。CNTは、そのまま水中に分散させようとすると、強い分子間の相互作用により、束状、粒状に凝集してしまう。CNTの光発熱特性を最大限に利用するためには、この凝集状態を解消し、CNTを水中に分子レベルで分散させる必要がある。今回、アビジン、ポリエチレングリコール(PEG)、リン脂質(PL)からなる分子(アビジン-PEG-PL)を単層CNT(SWCNT)の表面にコーティングさせることで水中へ分散させた。一方、リポソームに温度感受性(42 ℃付近で構造変化)を与えるため、各種リン脂質とコレステロールの配合量を調整のうえ、ビオチンと蛍光分子(ニトロベンゾオキサジアゾール(NBD))を表面に結合させた。そして、アビジンとビオチンの結合を利用した自己組織化によりCNTとリポソームからなる分子複合体(ナノ電車)を作製した。この分子複合体は、NBDによって緑色蛍光を有する粒子状会合体であるが(図1(b))、図1(a)のようなCNTの表面にいくつかのリポソームが結合した構造を形成することがわかった(図1(c))。なお、CNTとリポソームからなる当該分子複合体は、電気エネルギーによって乗客となる分子を最短ルートで運び、目的位置で降ろすことが可能であるため、今回、この分子複合体のことをナノスケールの電車にたとえて「ナノ電車」と命名した。
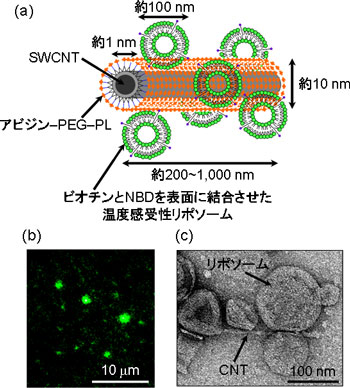 |
図1 CNT-リポソーム分子複合体(ナノ電車)の構造解析
(a) ナノ電車の概念図、(b) 蛍光顕微鏡写真、(c) 透過型電子顕微鏡写真 |
作製したナノ電車をポリジメチルシロキサン(PDMS)とガラス基板からなる直線状のマイクロ流体デバイス(幅100 µm、深さ50 µm)のスタート地点に入れ、電圧を加えてナノ電車の運動機能を解析した(図2(a))。電圧をかけるとマイナス電荷をもつ分子複合体はマイナス極からプラス極に向かって最高速度約700 µm/sで進むことがわかった(図2(b))。さらに、迷路状のマイクロ流体デバイスのスタート地点に入れ、電圧をかけたところ、電位勾配に従い、スタートからゴール地点に向かって最短ルートで進むことを発見した(図2(c)、(d))。
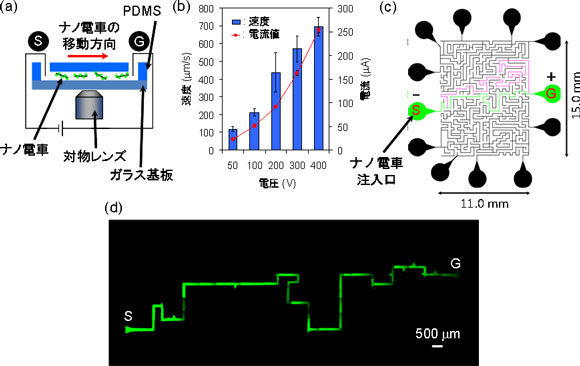 |
図2 ナノ電車の運動解析
(a)ナノ電車の速度解析のための実験装置、(b)速度解析結果、(c)迷路状マイクロ流体デバイスの仕様(緑:最短ルート、ピンク:最長ルート、黒いピン部分:最短ルートではないがゴールになり得る出口、注意:ナノ電車は、図中の白抜きの部分ではなく線上を動く)、(d)ナノ電車による最短ルートでの迷路解読(この場合は1分30秒でゴールに到達した) |
今回開発したCNT-リポソームからなるナノ電車を用いて、目的位置まで分子を運んだ後、放出させることで酵素反応の遠隔制御を試みた(図3(a))。なお、このケースのナノ電車では、図1に示したものとは異なり、温度解析を実施するために温度応答性色素ローダミンBを結合させたリポソームを用いている。目的位置には酵素(β-ガラクトシダーゼ(β-Gal))を配置した。温度感受性リポソームには、β-Galの基質となるフルオレセイン-ジ-β-D-ガラクトピラノシド(FDG)を内包させた。FDGはβ-Galによって加水分解されるとフルオレセインとなり緑色の蛍光を発する(図3(b))。目的位置にレーザー光を照射したところ、FDGの加水分解を示す緑色の蛍光を観測できた(図3(c))。これは、CNTの光発熱特性のためレーザー光照射によって、CNT近くの温度が急激に上昇(最大で約53 ℃)して、温度感受性リポソームの構造が変化し、内部のFDGが放出され、β-Galによってフルオレセインに変換されたことを示唆している。なお、CNTがない場合は、いずれのレーザー出力でもFDGの放出や温度上昇が起こらない。
今回開発した分子伝送システムは、マイクロメートルスケールにおける極微小で微量のナノ物質の輸送・分離や解析を利用した病気の発生・進行を未然に防ぐ予防医療のための高性能マイクロ流体デバイスの開発などへ応用が期待される。
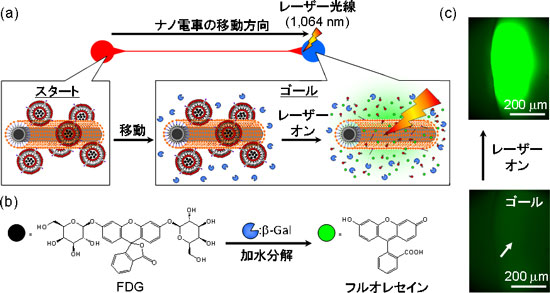 |
図3 ナノ電車の機能解析
(a) 目的場所における分子運搬および放出による酵素反応の誘発(リポソーム中の赤い粒子:ローダミンBを結合したリン脂質(温度解析に利用))、(b) β-GalによるFDGの加水分解反応の模式図、(c) 酵素反応誘発の蛍光顕微鏡による観察
|
今後は、基板上で高度に運動・構造制御できる機能化分子複合体を開発し、微小パターン内で分子(薬物、DNA、RNA、タンパク質、糖など)を目的の位置まで高速運搬し、運搬先で化学反応などを誘発できるマイクロ流体デバイスを開発する。