2025年ノーベル生理学・医学賞「末梢性免疫寛容」とは?
2025年ノーベル生理学・医学賞「末梢性免疫寛容」とは?

2025/12/10

2025年ノーベル生理学・医学賞
「末梢性免疫寛容」
とは?
制御性T細胞の発見とそのはたらき
科学の目でみる、
社会が注目する本当の理由

末梢性免疫寛容とは?
病原体などを攻撃する免疫系は、同時に「自己を攻撃しない」ことが重要です。自己を攻撃する免疫細胞の活性を抑える特殊な免疫細胞が「制御性T細胞」であり、制御性T細胞による免疫抑制が「末梢性免疫寛容」です。自己免疫疾患やがん、アレルギー治療などに応用できるとして医学研究でも注目されています。
2025年のノーベル生理学・医学賞は、米国システム生物学研究所のメアリー・E・ブランコウ博士、米国ソノマ・バイオセラピューティクス社のフレッド・ラムズデール博士、そして大阪大学特任教授・特別栄誉教授の坂口志文博士に授与されました。坂口博士は、免疫反応を抑える特殊な免疫細胞「制御性T細胞」を発見しました。一方、ブランコウ博士とラムズデール博士は、IPEX症候群という自己免疫疾患の遺伝子変異を特定し、その遺伝子が制御性T細胞に必須であることを坂口博士が明らかにしました。制御性T細胞は、がんやアレルギーなどにも関わっていると考えられており、今後新たな治療法の開発につながる可能性を秘めています。
制御性T細胞とは
私たちの周囲には常に細菌やウイルスなどの病原体が存在していますが、ほとんどの場合は症状を引き起こすことなく過ごしています。これは、病原体を異物として攻撃、排除する「免疫系」という機能が私たちの体に備わっているからです。一方で、1型糖尿病や関節リウマチなどの自己免疫疾患は、本来攻撃してはいけない自分自身の細胞を攻撃してしまうという、いわば免疫系の暴走が原因と考えられています。
このように、免疫系には「自分の細胞(自己)は攻撃せず、自分以外の異物(非自己)は攻撃する」という、絶妙なバランスが要求されます。免疫系を担う免疫細胞のうち、T細胞と呼ばれるグループは胸腺という器官で成熟し、このときに自己を攻撃するT細胞は排除されます(T細胞のTは胸腺:Thymusに由来)。しかし実際には全ての自己攻撃性T細胞は排除されず、体全体を巡るようになり、何らかのきっかけで自己免疫疾患などの原因になると考えられています。
そこで坂口博士が発見したのが、胸腺でつくられる特別なT細胞「制御性T細胞」です。制御性T細胞は攻撃の役割を担わず、自己を攻撃するT細胞の活性を抑えられます。ノーベル財団のプレスリリースでは、制御性T細胞のことを「免疫系のセキュリティガード(警備員)」と表現しています。身内である他のT細胞が自己を攻撃するというミスをしないか、見張っているというわけです。胸腺で産生されるT細胞全体のうち、制御性T細胞はわずか10 %程度とされています。わずかな量の細胞が、免疫系のバランスを担っているのです。
胸腺において、自己を攻撃するT細胞が排除されることで自己が攻撃されないしくみを「中枢性免疫寛容」といいます。これに対して、各臓器や器官レベルで制御性T細胞による免疫機能の無力化が「末梢性免疫寛容」と呼ばれる現象です。
ノーベル賞受賞のポイント
自己免疫疾患を抑えるT細胞も胸腺で作られる
精神科医を目指して京都大学医学部に入学した坂口博士は、講義で自己免疫疾患を知ります。「自己は攻撃せず、非自己は攻撃する」という免疫系の二律背反性に衝撃を受け、そこには巧妙なメカニズムがあるはずだと考え、その解明に挑もうとしました。
京都大学大学院に進学した坂口博士は、人生を一変させる論文を偶然見つけます。1969年に愛知県がんセンターから発表された論文*1で、生後3日目のマウスから胸腺を摘出するという実験でした。T細胞をつくる場である胸腺がなければ、免疫反応が弱くなるはずです。しかし結果は正反対で、さまざまな臓器で自己免疫疾患による炎症が起きていました。この謎を解き明かすため、坂口博士は愛知県がんセンターに移ります。そして1982年、胸腺を摘出したマウスに、健康な別のマウスから採取したT細胞を移植すると炎症反応が起きないことを発見*2しました。これは、T細胞の集団の中に、免疫反応を抑えるセキュリティガード役となる特別なT細胞がいることを意味します。
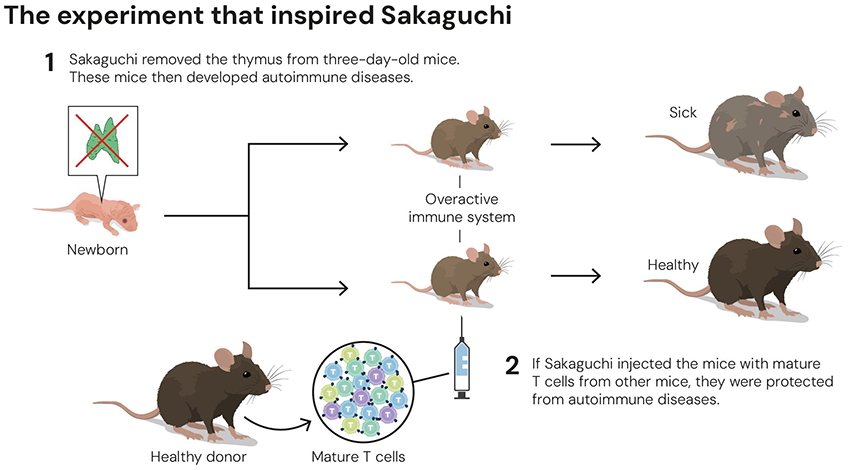 生後3日目のマウスから胸腺を摘出すると自己免疫疾患を発症するが、T細胞を移植すると発症しない(ノーベル財団プレスリリースより引用)
生後3日目のマウスから胸腺を摘出すると自己免疫疾患を発症するが、T細胞を移植すると発症しない(ノーベル財団プレスリリースより引用)
冬の時代を乗り越えて
しかし、この坂口博士の成果は無視されるどころか強い反発がありました。少し前の1970年代、免疫反応を抑える「抑制性T細胞(サプレッサーT細胞)」仮説がブームとなり、盛んに研究がされていました。ところが1983年、サプレッサーT細胞に特徴的な分子をつくるはずの遺伝子がT細胞内には存在しない*3ことがわかり、サプレッサーT細胞仮説に否定的な見方が一気に強まりました。免疫反応を抑制するT細胞の研究自体がタブー視されるようになり、坂口博士の発見もサプレッサーT細胞と混同されたのです。まさに冬の時代でした。
それでも坂口博士は、「客観的に見分ける方法で分子や遺伝子レベルの実体をつかめばいい」と考え、免疫反応を抑えるT細胞の特定に挑みました。細胞表面には細胞の種類ごとに特徴的な分子があり、例えばT細胞表面にはCD4という分子があります。坂口博士は、免疫反応を抑えるT細胞の表面にはさらに別の分子があるはずだと考え、1995年、CD25という分子を表面にもつT細胞(CD4陽性CD25陽性T細胞)を特定*4しました。先ほどのT細胞移植実験で、CD4陽性CD25陽性T細胞だけを除いたT細胞集団を移植しても炎症反応が起きることがわかり、この細胞こそが免疫反応を抑えていることを実証しました。
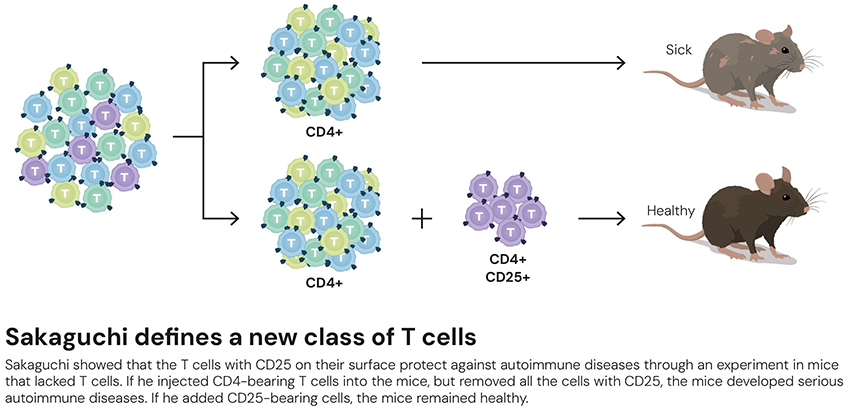 移植実験で、自己免疫疾患を抑えるにはCD4陽性CD25陽性T細胞(紫で示したT細胞)が必要であることがわかった(ノーベル財団プレスリリースより引用)
移植実験で、自己免疫疾患を抑えるにはCD4陽性CD25陽性T細胞(紫で示したT細胞)が必要であることがわかった(ノーベル財団プレスリリースより引用)
2000年、坂口博士は総説*5の中で、CD4陽性CD25陽性T細胞を改めて「制御性T細胞」と表現し、この頃になると制御性T細胞の存在が少しずつ認められるようになります。
自己免疫疾患の原因遺伝子の発見
一方、メアリー・E・ブランコウ博士とフレッド・ラムズデール博士は当時、バイオテクノロジー企業のセルテック・カイロサイエンス社に所属しており、あるマウスの研究に取り組んでいました。「ふけだらけ」という意味のスカーフィ(Scurfy)と呼ばれたそのマウスは、うろこ状で剝離する皮膚、極端に肥大した脾臓とリンパ節が特徴で、約2年が寿命のマウスにおいて数週間しか生きられません。この原因となる遺伝子を探索していたのです。
1990年代に疾患の遺伝子を特定することは困難な作業でしたが、数年かけてようやく遺伝子変異を発見し、Foxp3と命名されました。さらに研究の過程で、2人はIPEX症候群というヒトの自己免疫疾患とスカーフィマウスの症状に共通点があることに注目しました。そして、マウスのFoxp3に対応する遺伝子がヒトにもあることを発見し、ヒトの対応遺伝子をFOXP3と名付けました。実際にIPEX症候群の患者ではFOXP3遺伝子が変異していることも判明し、たった1つの遺伝子変異が重篤な自己免疫疾患の原因であることを突き止め、2001年に発表*6*7*8しました。
Foxp3は制御性T細胞特有の遺伝子
坂口博士の研究室に博士研究員として加わった堀昌平博士(現・東京大学教授)が注目したのが、発見されたばかりのFoxp3遺伝子です。当時、Foxp3遺伝子の詳細な機能は不明でしたが、坂口博士は直感的に制御性T細胞と関係していると考えて調べることにしました。
結果は想像どおりで、制御性T細胞においてのみFoxp3遺伝子が活性化していました。さらに、未成熟なT細胞でFoxp3遺伝子を強制的に活性化させると、制御性T細胞に変化*9することがわかりました。Foxp3遺伝子こそが制御性T細胞に決定的な遺伝子だったのです。これを機に、制御性T細胞の研究が急激に進むようになりました。
かつての免疫学では、自己と非自己の認識は生まれつき確固たるものと考えられていました。しかし、制御性T細胞の研究によって、自己と非自己の境界は制御性T細胞の欠損によって自己免疫疾患を引き起こすほど揺らぐものであり、動かせるものであるという新しい価値観をもたらした点が画期的であり、ノーベル賞にふさわしいと判断されたのでしょう。
今後の展望
制御性T細胞に注目し、免疫反応をコントロールして疾患治療に応用する研究が世界中で行われています。例えば、多くのがんでは全T細胞中における制御性T細胞の割合が増えており、生命予後(死亡率など)に関係します*10。単にT細胞全体を活性化させる薬やワクチンがあっても、制御性T細胞も活性化してしまい、結局効果がないということになります。そこで、先に制御性T細胞を減らす、または不活化するという方法が考えられ、各国で臨床試験が行われています。
他には、自己免疫疾患や臓器・骨髄移植後の免疫反応を抑制するために制御性T細胞を増やすことも考えられ、制御性T細胞を増やす薬剤または制御性T細胞そのものを投与する臨床試験*11*12*13もあります。坂口博士が創業者で、現在は米国に拠点を置くレグセル社は、制御性T細胞を医薬品として自己免疫疾患の患者に投与する臨床試験を計画中です。
もちろん、制御性T細胞そのものの研究も続いています。制御性T細胞がどのように自己攻撃性T細胞を抑制しているのか、そのメカニズムが全て解明されたわけではありません。また、胸腺の中でどのようにして制御性T細胞がつくられるのか詳細な過程はまだわかっていません。その過程において制御性T細胞はさらにいくつかのグループに分類できると考えられ、それぞれの特徴を明らかにすることで、さらに医学への応用につながる可能性が高まります。
基礎研究から医学への応用に向かって急速に研究が進んでいるのが、制御性T細胞の現在地といえます。
(監修:細胞分子工学研究部門 細胞動態システム研究グループ 主任研究員 熊谷雄太郎)
*1: Yasuaki Nishizuka, Teruyo Sakakura ,Thymus and Reproduction: Sex-Linked Dysgenesia of the Gonad after Neonatal Thymectomy in Mice.Science166,753-755(1969). DOI:10.1126/science.166.3906.753 [参照元へ戻る]
*2: S Sakaguchi, T Takahashi, Y Nishizuka; Study on cellular events in postthymectomy autoimmune oophoritis in mice. I. Requirement of Lyt-1 effector cells for oocytes damage after adoptive transfer.. J Exp Med 1 December 1982; 156 (6): 1565–1576. doi: https://doi.org/10.1084/jem.156.6.1565 [参照元へ戻る]
*3: M. Kronenberg,M. Steinmetz,J. Kobori,E. Kraig,J.A. Kapp,C.W. Pierce,C.M. Sorensen,G. Suzuki,T. Tada, & L. Hood, RNA transcripts for I-J polypeptides are apparently not encoded between the I-A and I-E subregions of the murine major histocompatibility complex., Proc. Natl. Acad. Sci. U.S.A. 80 (18) 5704-5708, https://doi.org/10.1073/pnas.80.18.5704 (1983). [参照元へ戻る]
*4: Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J Immunol. 1995 Aug 1;155(3):1151-64. PMID: 7636184. [参照元へ戻る]
*5: Shimon Sakaguchi, Regulatory T Cells: Key Controllers of Immunologic Self-Tolerance, Cell, Volume 101, Issue 5, 2000, Pages 455-458, ISSN 0092-8674, https://doi.org/10.1016/S0092-8674(00)80856-9. [参照元へ戻る]
*6: Wildin, R., Ramsdell, F., Peake, J. et al. X-linked neonatal diabetes mellitus, enteropathy and endocrinopathy syndrome is the human equivalent of mouse scurfy. Nat Genet 27, 18–20 (2001). https://doi.org/10.1038/83707 [参照元へ戻る]
*7: Bennett, C., Christie, J., Ramsdell, F. et al. The immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome (IPEX) is caused by mutations of FOXP3. Nat Genet 27, 20–21 (2001). https://doi.org/10.1038/83713 [参照元へ戻る]
*8: Brunkow, M., Jeffery, E., Hjerrild, K. et al. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse. Nat Genet 27, 68–73 (2001). https://doi.org/10.1038/83784 [参照元へ戻る]
*9: Shohei Hori et al. ,Control of Regulatory T Cell Development by the Transcription Factor Foxp3.Science299,1057-1061(2003). DOI:10.1126/science.1079490 [参照元へ戻る]
*10: Hiroyoshi Nishikawa, Shimon Sakaguchi, Regulatory T cells in cancer immunotherapy, Current Opinion in Immunology, Volume 27, 2014, Pages 1-7, ISSN 0952-7915, https://doi.org/10.1016/j.coi.2013.12.005. [参照元へ戻る]
*11: Feng, R., Xiao, X., Wang, Y. et al. Metabolic impact of low dose IL-2 therapy for primary Sjögren’s Syndrome in a double-blind, randomized clinical trial. Clin Rheumatol 43, 3789–3798 (2024). https://doi.org/10.1007/s10067-024-07165-2 [参照元へ戻る]
*12: Roberta Lorenzon, Claire Ribet, Fabien Pitoiset, Selim Aractingi, Beatrice Banneville, Laurent Beaugerie, Francis Berenbaum, Patrice Cacoub, Julien Champey, Olivier Chazouilleres, Christophe Corpechot, Bruno Fautrel, Arsène Mekinian, Elodie Regnier, David Saadoun, Joe-Elie Salem, Jérémie Sellam, Philippe Seksik, Eric Vicaut, Michelle Rosenzwajg, David Klatzmann, The universal effects of low-dose interleukin-2 across 13 autoimmune diseases in a basket clinical trial, Journal of Autoimmunity, Volume 144, 2024, 103172, ISSN 0896-8411, https://doi.org/10.1016/j.jaut.2024.103172. [参照元へ戻る]
*13: Claudio G. Brunstein, Jeffrey S. Miller, Qing Cao, David H. McKenna, Keli L. Hippen, Julie Curtsinger, Todd DeFor, Bruce L. Levine, Carl H. June, Pablo Rubinstein, Philip B. McGlave, Bruce R. Blazar, John E. Wagner; Infusion of ex vivo expanded T regulatory cells in adults transplanted with umbilical cord blood: safety profile and detection kinetics. Blood 2011; 117 (3): 1061–1070. doi: https://doi.org/10.1182/blood-2010-07-293795 [参照元へ戻る]