国立研究開発法人 産業技術総合研究所【理事長 石村 和彦】(以下「産総研」という)生物プロセス研究部門【研究部門長 鈴木 馨】生物システム研究グループ 奥田 徹哉 主任研究員は、日本特殊陶業-産総研ヘルスケア・マテリアル連携研究ラボ 加藤 且也 連携研究ラボ長と共同で、IgMという種類の抗体を、その機能を維持したまま効率よく精製できる技術を開発した。
抗体にはさまざまな種類があり、産業用途には主にIgGという種類の安定な抗体が用いられている。一方、糖鎖に結合する抗体などでは高機能なIgMが得られるため、医薬品用途でのIgMの利活用が期待されている。しかし、IgMは構造的に不安定であるため精製過程で抗原への特異的な結合力が失われやすく、夾雑タンパク質などの不純物を含む血清や細胞培養液などの原料からIgMを実用的に精製する技術は確立されていなかった。
今回、産総研と日本特殊陶業株式会社(以下「日本特殊陶業」という)とで共同開発した抗体精製用の多孔質セラミックス粒子(PZPs)を用いて、IgMの機能を維持したまま、高い収率で原料から精製する手法を確立した。操作も容易で、精製後の加工に適した高純度のIgMが得られるため、医薬品などの産業用途のIgM製造に応用できる。
IgMはウイルスの検出やがん治療での有効性が注目されており、今回開発した技術の応用によってIgMを活用した新たな抗体医薬品や感染症の診断薬などの開発への貢献が期待される。
なお、この技術の詳細は、2021年2月9日にScientific Reports誌(電子版、オープンアクセス)に掲載される。
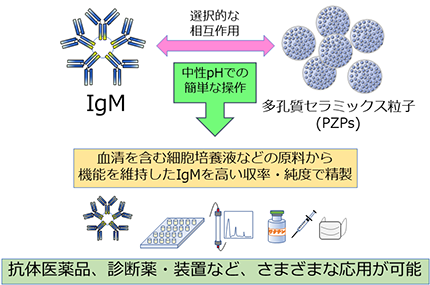
今回開発したIgM精製技術の概要と用途
抗体の機能を応用した医薬品の市場は今後も拡大していくと考えられている。抗体は標的分子に特異的に作用できることから、少ない副作用で高い効果が期待できる。一方で、抗体の新たな標的分子の探索が難しくなってきたことや、製造コストが高いため薬剤として高額となるなどの問題がある。
がん細胞や微生物・ウイルスの表層にみられる糖鎖は、抗体の新たな標的分子として注目されているが、糖鎖を認識する抗体の開発に必要な技術開発が遅れている。特に、糖鎖を認識する抗体のうち高機能なものの多くがIgMであるが、IgGの製造に最適化された従来技術ではIgMの精製が困難であることが医薬品応用への障壁となっていた。
産総研は、糖鎖を認識する抗体を効率よく作製する技術を開発しており、この技術によってがんやウイルス感染症に関わる細胞表層の糖鎖を認識するさまざまな種類の抗体を獲得してきた(2020/03/30産総研主な研究成果)。これらの抗体のうち、抗原に強い結合力で特異的に反応する抗体の多くがIgMであったため、IgMの医薬品応用に必要な技術開発に取り組んでいた。他方、産総研は日本特殊陶業との共同研究で抗体分離精製のための高性能なセラミックス粒子の開発に取り組んでいた(2019/01/28産総研プレス発表)。今回、これらの研究開発を融合させてIgMの精製技術の開発に取り組んだ。
なお、本研究開発は、独立行政法人日本学術振興会の科学研究費補助金「19K11810 (2019~2021年度)」による支援を受けて行ったものである。
既存の抗体精製には、強酸を用いる工程があり、酸に対して不安定なIgMでは抗体が変性しやすく活性が維持できないなどの問題があった。中性条件で精製が可能な技術もあったが、不純物が含まれる原料から簡単に精製できないことや、収率が低いことが問題となっていた。そこで抗体が変性しない中性条件にて、簡単な操作でIgMを精製できる材料を探したところ、日本特殊陶業-産総研ヘルスケア・マテリアル連携研究ラボが開発したセラミックス粒子(多孔質ジルコニア粒子:PZPs、図1)が、今回の目的のIgM精製技術に適した材料であることがわかった。

図1 PZPsの電子顕微鏡画像(左)とリン酸化合物による表面修飾のイメージ図(右)
PZPsは、抗体のサイズと同程度の孔径(10 nm)をもつ多孔質粒子で、リン酸化合物による表面修飾によって、抗体と選択的な親和性を示す。今回、抗体産生細胞の培養液からのIgM精製にPZPsを適用し、pH7~8の中性のリン酸緩衝液を用いた遠心沈降により実用的な収率でIgMを精製する手法を確立した。この手法にて抗体産生細胞の培養液から精製したIgMを、SDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)で解析した結果を図2に示す。原料にはIgMが0.3%しか含まれていないため目視では存在が確認できないが、精製後はアルブミンなどの夾雑タンパク質を99%以上除去できるため、IgMが主成分として検出された。また、抗体の含有量が高い腹水をこの手法で精製すると、96%以上の高収率でIgMを得られた。中性条件での抗体精製は既存のセラミックス粒子を用いる技術でも可能であったが、セラミックスはタンパク質の吸着力が弱いため、収率が低いことが実用化の課題となっていた。今回用いたPZPsは多孔質化によって比表面積が従来のセラミックス粒子と比べて13倍以上ある。そのため、抗体の結合容量が飛躍的に向上し、高い収率を実現できた。精製後の加工に適した溶液として、高純度で抗体を回収できるため、薬剤標識などにそのまま用いることができる。
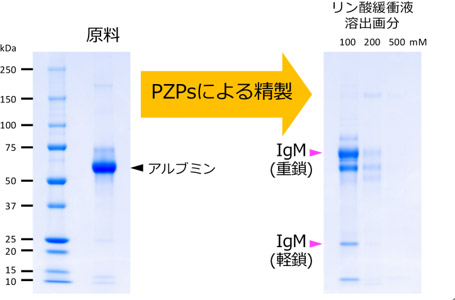
図2 PZPsを用いて精製したIgMのSDS-PAGE解析像
抗体産生細胞の培養液(原料)より精製したIgMを還元条件で分析しており、重鎖と軽鎖に別れて検出される。本手法では抗体の種類により至適な溶出塩濃度が異なり、このIgMは100 mMが至適濃度であった。
今回開発した技術の汎用性を検証するために、4種類のIgMやIgGの精製を試みたところ、溶出に用いるリン酸緩衝液の塩濃度を調整するだけで、すべての抗体を精製できた。また、精製した抗体はすべて変性することなく抗原の構造を認識する特異性と結合力を維持していた(図3)。
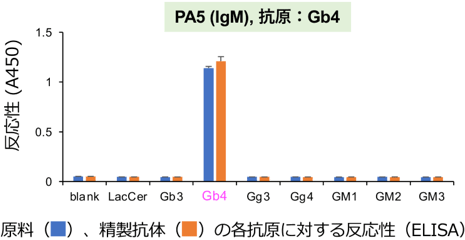
図3 精製したIgMの抗原への反応性
精製抗体の特異的な結合力を解析した一例を示す。マゼンタで示した抗原(Gb4)のみへの特異的な反応性を維持しており、類似の構造の糖鎖には反応していない。
今回の手法ではIgGも精製できるが、抗体の種類により溶出時の至適塩濃度が異なるので、溶出条件を調節することでさまざまな抗体が混在する試料から目的の抗体のみを選択的に精製することもできる。また、従来のIgM精製技術ではκ鎖やλ鎖という抗体の軽鎖の種類によっては精製できないものもあったが、今回開発した技術では軽鎖の種類を問わずに精製できる。今回用いた抗体はマウス由来の抗体であるが、ヒトやウシなどの抗体も精製できるので、これまで困難であったさまざまな種類の抗体精製への応用が見込まれ、抗体医薬品の精製プロセスなどの創薬分野での活用が期待される。
2019年にプレス発表した抗体精製用セラミックス粒子の新たな活用法として、IgMやIgGの精製キットに応用できることが分かったため、製品化に向けて精製条件やサンプル調製方法を最適化する。薬剤標識などの抗体の加工プロセスへの応用など、用途の拡大についても検討する。今回の技術で精製したIgMを活用したがんや感染症の診断薬や抗体医薬品などの開発も検討する。