国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)生物プロセス研究部門【研究部門長 鈴木 馨】バイオデザイン研究グループ 奥田 徹哉 主任研究員は、生体分子の一つである“糖鎖”を認識する抗体の作製を容易にする化合物(人工糖脂質)を開発した。また富士フイルム和光純薬株式会社と共同で、今回開発した人工糖脂質によって肝細胞がんの診断に利用できる抗体を産生できることを示した。
糖鎖は疾患のマーカーとして有用であり、糖鎖を認識する抗体が自在に開発できれば、新しい診断マーカーやワクチンを開発できるようになる。しかし、動物では糖鎖を認識する免疫システムがあまり発達していないことから、糖鎖では強い免疫応答を起こせないため、タンパク質抗原に対する抗体の産生に最適化された従来技術では実用的な抗体の作製は困難であった。
今回、セラミドアナログと化学結合させた人工糖脂質を作り動物に投与すると、糖鎖を認識する抗体の産生を促進できることを発見した。この方法を応用することで、がんなどの診断薬や感染症に対するワクチンなどの開発への貢献が期待される。
なお、この成果の詳細は、2019年12月11日にScientific Reports誌(電子版、オープンアクセス、https://doi.org/10.1038/s41598-019-55088-9)に掲載された。
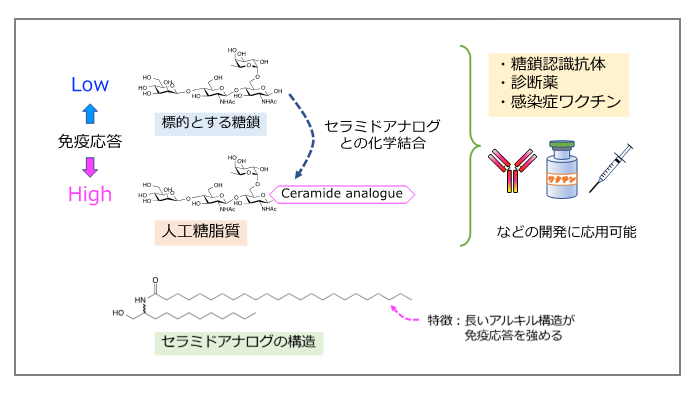
今回開発した人工糖脂質の概要と用途
核酸、タンパク質に続く第3の生命鎖として、“糖鎖”が注目されている。生体内には多様な構造の糖鎖が糖タンパク質や糖脂質として存在しており、ヒト疾患の要因となる糖鎖も多く見つかっていることから、新しい創薬ターゲットとして期待されている。糖鎖を認識する抗体が自在に開発できれば、抗体医薬品や診断薬、ワクチンの開発に応用できる。しかし、糖鎖は動物体内で強い免疫応答を起こせないため、タンパク質に対する抗体の産生に最適化された従来技術では実用的な抗体の作製は困難であった。既存の糖鎖認識抗体は偶然に得られたれたものがほとんどで種類も限られており、糖鎖に適した抗体作製技術の開発が望まれていた。
産総研は、任意の構造の糖鎖を認識する抗体の作製技術の確立を目指しており、その要素技術となる人工糖脂質の開発に取り組んできた。将来的には人工糖脂質による抗体作製技術によって、哺乳動物体内の全ての糖鎖構造に対して抗体を開発することを目標としており、これらを網羅できる基本特許の取得も国内外で進めてきた。現在までに、哺乳動物由来糖鎖の特徴構造を網羅できる範囲で、人工糖脂質の物質特許が成立している。(特許6143240号、US10307471B2など)
なお、本研究開発は、独立行政法人 日本学術振興会の科学研究費補助金「15K15201、15H02907、19K11810」2015~2019年度)」と日本科学財団の笹川研究助成「F19-234」による支援を受けて行った。
産総研では、炎症が起きた細胞が合成する糖脂質は、強い免疫応答を引き起こす作用を持つことを発見していた。この糖脂質の脂質部位に免疫応答を強めるための構造的特徴が見つかり、これを模倣したセラミドアナログとターゲットとする糖鎖とを化学結合させた人工糖脂質を考案した。正常細胞やがん細胞に存在するさまざまな糖鎖とセラミドアナログからなる人工糖脂質を合成し、マウスに投与したところ、マウスの血中にターゲットの糖鎖構造を認識する抗体が産生された。その仕組みを調べたところ、このセラミドアナログには糖鎖を免疫細胞に効率よく認識させる特性があり、よって糖鎖に対する強い免疫応答が起こることがわかった。従来技術にはこのような特性の化合物はなく、これまでは困難であった糖タンパク質の糖鎖に反応する抗体も人工糖脂質を用いることで産生を促進できた。そこで富士フイルム和光純薬株式会社と共同研究を行い、肝細胞がんの診断マーカーであるAFP-L3糖タンパク質に着目し、その特徴構造となっている糖鎖からなる人工糖脂質(CF4-C12L)を合成した。これをマウスに投与すると、血中で抗体が多く産生された。産生された抗体は、AFP-L3の糖鎖構造を特異的に認識するものであった(図1)。
肝疾患の診断マーカーとしてAFP糖タンパク質(AFP-L1)が知られている(図1)。この糖タンパク質は、肝疾患全般(肝細胞がんや肝炎、肝硬変など)で血中に増加するが、肝細胞がんではコアフコース構造の付いたAFP-L3の合成量が増えることが知られていた。そのため、AFP-L3を抗体により検出することで、肝細胞がんの精度のよい診断ができると期待されている。しかし、AFP-L3は動物体内にて強い免疫応答を引き起こせないため、抗体の作製が困難であった。今回開発した人工糖脂質(CF4-C12L)はAFP-L3に特徴的なコアフコース構造を含む糖鎖とセラミドアナログからなる。これを投与したマウスでは、AFP-L3を認識する抗体が血中に多く産生されていることが確認できた(図1、右上)。一方で、これらの抗体のAFP-L1への反応性は低く、AFP-L3のコアフコース構造を特異的に認識する抗体が増加していることがわかった。
これらの成果は、今回開発した人工糖脂質が糖鎖を認識する抗体の開発に有用であることを実証しており、その応用によってがんに特異的な糖鎖をターゲットとした診断薬や抗体医薬品の開発が期待できる。
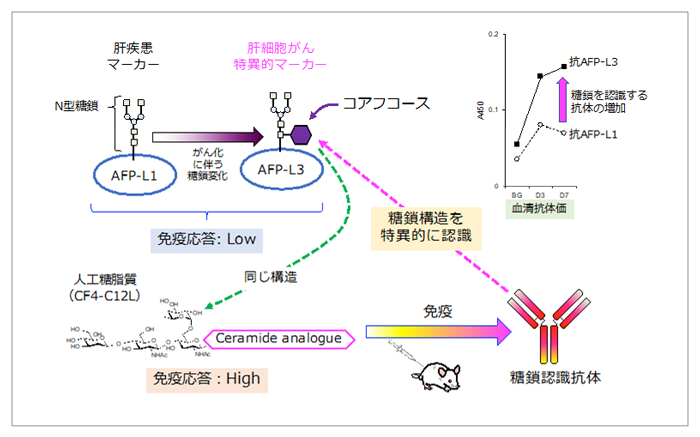
図1 人工糖脂質による肝細胞がんマーカーの抗体産生の仕組み
図中、血清の採取日をBG(投与前)、D3(投与後3日目)、D7(投与後7日目)と略してある。
今回開発した人工糖脂質は、がんに特異的な糖鎖をターゲットとした抗体医薬品や診断薬の開発に資する新素材であり、有用な糖鎖認識抗体の開発を進める。また、世界的には糖鎖認識抗体は薬剤耐性菌や小児感染症のワクチン開発の創薬ターゲットとして研究が進んでおり、この分野への技術の応用についても研究を進める。
国立研究開発法人 産業技術総合研究所
生物プロセス研究部門 バイオデザイン研究グループ
主任研究員 奥田 徹哉 E-mail:t-okuda*aist.go.jp(*を@に変更して送信下さい。)