国立研究開発法人 産業技術総合研究所【理事長 石村 和彦】(以下「産総研」という)ナノ材料研究部門【研究部門長 原 重樹】ナノバイオ材料応用グループ 中村 真紀 主任研究員、CNT機能制御グループ 湯田坂 雅子 客員研究員らは、国立大学法人 信州大学【学長 濱田 州博】(以下「信州大」という)先鋭領域融合研究群 バイオメディカル研究所 齋藤 直人 所長らと共同で、破骨細胞の抑制剤を内包したナノ複合体を開発した。複合化により薬剤の効果の増加が確認されており、転移性骨腫瘍の治療に役立つと期待される。
転移性骨腫瘍では、破骨細胞の増殖を抑制することにより、骨破壊の軽減や痛みの緩和などによる患者の生活の質(QOL)の改善が見込まれる。今回、破骨細胞抑制剤であるイバンドロネートの効果を増加させるために、イバンドロネートをカーボンナノホーンとリン酸カルシウムとに複合化した破骨細胞抑制剤内包ナノ複合体(ナノ複合体)を新たに作製した。このナノ複合体はイバンドロネートの単独使用に比べて少量で破骨細胞の増殖を抑制した。このナノ複合体により、イバンドロネートの効果が増加された新しい転移性骨腫瘍治療法の開発への貢献が期待される。
なお、この技術の詳細は、2021年1月7日(米国東部標準時間)に米国化学会の学術誌ACS Applied Materials & Interfacesにオンライン掲載される。
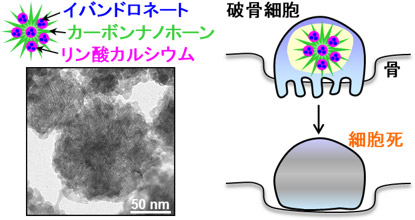
破骨細胞抑制剤内包ナノ複合体の模式図(左上)、電子顕微鏡写真(左下)、破骨細胞に対して期待される役割(右)
骨を作る骨芽細胞と骨を溶かして吸収(骨吸収)する破骨細胞がバランス良く働くことにより、健康な骨が維持される。一方、骨に到達したがん細胞が増殖して転移性骨腫瘍を形成すると、破骨細胞が活性化されて骨吸収が進行するため、骨がもろくなり骨折や強い痛みを生じるなど患者のQOLが著しく低下する。また、壊された骨からがんを増殖させるタンパク質が放出され、がんが進展する。破骨細胞抑制剤であるビスホスホネートは骨の表面に強く吸着し、骨の成分と共に破骨細胞に取り込まれて細胞死を誘導する。破骨細胞が減ると骨吸収が抑えられ、骨の破壊や痛みの軽減と同時にがん細胞の増殖抑制も期待できる。しかし、ビスホスホネートは静脈内に投与されるため、全身循環による重篤な副作用の発生も報告されており、少量のビスホスホネートで効果が出る薬剤送達システムの実用化が望まれている。
産総研では、直径100 nm程度の球状構造で物質吸着能力も高いカーボンナノホーン集合体が薬剤送達システムの薬剤運搬体として有用と考え、これまでに薬剤送達システムへの応用に適したカーボンナノホーンの表面修飾技術や薬剤複合化技術を開発してきた(2008年9月23日、産総研プレス発表)。また骨の主要無機成分であり、優れた生体親和性を示すリン酸カルシウムのナノメートル~サブマイクロメートルサイズの粒子が薬剤運搬体として有用と考え、薬剤や抗菌剤などとの複合粒子作製技術を開発してきた(2016年11月18日、産総研主な研究成果)。一方、信州大では、カーボンナノチューブなどのナノカーボン材料を用いた破骨細胞抑制剤の研究・開発を進めてきた(2014年4月18日、信州大学プレス発表)。
今回、カーボンナノホーンを薬剤運搬体とし、ビスホスホネートと複合化させることで、効果の増加と副作用の軽減を目指した。
なお、今回の研究開発は、独立行政法人 日本学術振興会 基盤研究(A)「癌転移骨環境を空間的・時間的に制御する生体活性付加カーボンの開発と安全性評価(2017~2021年度)、研究代表 齋藤 直人(信州大)」、挑戦的研究(萌芽)「転移性骨腫瘍治療を指向した機能性ナノカーボン粒子の創製(2021~2022年度)、研究代表 中村 真紀(産総研)」による支援を受けて行った。
今回、低毒性で破骨細胞への取り込みに適したサイズであるカーボンナノホーン集合体を薬剤運搬体として用いた。産総研の持つカーボンナノホーンの表面修飾・薬剤複合化技術やリン酸カルシウムの複合粒子作製技術を応用し、リン酸カルシウムを仲介させてカーボンナノホーンとビスホスホネートの一種であるイバンドロネートを複合化させることにより、破骨細胞抑制剤内包ナノ複合体(ナノ複合体)を作製した。強力な疎水基を持たないイバンドロネートは、疎水性の高いカーボンナノホーンにほとんど吸着せず直接複合化することができないため、イバンドロネートと親和性の高いリン酸カルシウムを仲介させることで複合化を実現できた。カーボンナノホーンとイバンドロネートをリン酸カルシウムの原料となるイオン水溶液(カルシウムイオンやリン酸イオンなどにより構成)に添加すると、カーボンナノホーン、イバンドロネート、リン酸カルシウムの3成分から成る破骨細胞抑制剤内包ナノ複合体を得ることができた。図1にナノ複合体の電子顕微鏡写真と元素分布を示す。

図1 破骨細胞抑制剤内包ナノ複合体の走査電子顕微鏡写真(左)、透過電子顕微鏡写真(中)、炭素(C、緑色)とカルシウム(Ca、桃色)の元素分布(右)
信州大では破骨細胞のモデルとなる細胞を培養し、それに今回開発したナノ複合体分散液を添加してナノ複合体の細胞への影響を評価した。ナノ複合体は細胞内に多く取り込まれ、細胞生存率を低下させる細胞抑制効果を示した(図2、赤)。添加したナノ複合体に含まれるのとほぼ同濃度のカーボンナノホーンやイバンドロネートを単独で添加しても細胞抑制効果は見られなかったことから(図2、緑・青)、複合化によってイバンドロネートの破骨細胞抑制効果が増加したといえる。細胞内に取り込まれたナノ複合体はリソソームという器官に集積する(図3左)。リソソーム内部は弱酸性に保たれており、中性から弱酸性環境になるにつれて溶解性を増すリン酸カルシウムがリソソーム内で徐々に溶解し、イバンドロネートを放出(図3中)、破骨細胞の細胞死を引き起こしたと考えられる(図3右)。従って、今回開発したナノ複合体を転移性骨腫瘍部位に局所投与すれば、がん細胞により活性化された破骨細胞に積極的に取り込まれ、少量で効率的にイバンドロネートによる破骨細胞抑制効果を発揮すると予想され、また、全身性の副作用の軽減も見込まれるため、転移性骨腫瘍治療への応用が期待される。
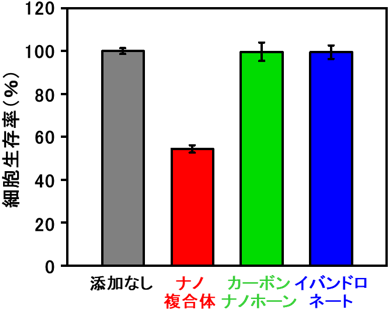
図2 破骨細胞抑制剤内包ナノ複合体、カーボンナノホーン、イバンドロネート添加48時間後の細胞生存率(サンプルを添加しない系(灰色)を100%として算出)
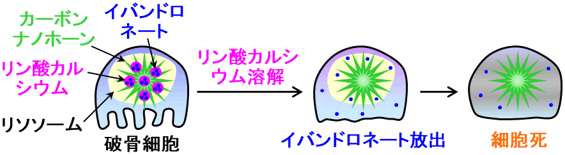
図3 破骨細胞に取り込まれた破骨細胞抑制剤内包ナノ複合体の予想される細胞内挙動の模式図
今後は動物実験などによる効果の検証を行い、それらの検証をもとに破骨細胞抑制剤内包ナノ複合体の構造および組成についてさらなる最適化を図り、より効率的に破骨細胞に取り込まれるように改良し、また、使用するビスホスホネートの種類なども検討して薬効を向上させ、臨床応用を目指す。
論文名:Ibandronate-Loaded Carbon Nanohorns Fabricated Using Calcium Phosphates as Mediators and Their Effects on Macrophages and Osteoclasts
著者:Maki Nakamura, Katsuya Ueda, Yumiko Yamamoto, Kaoru Aoki, Minfang Zhang, Naoto Saito, Masako Yudasaka
雑誌名:ACS Applied Materials & Interfaces
DOI:https://dx.doi.org/10.1021/acsami.0c20923