独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)ナノチューブ応用研究センター【研究センター長 飯島 澄男】機能性ナノチューブチーム 湯田坂 雅子 研究チーム長と張 民芳 産総研特別研究員らは、学校法人 藤田学園 藤田保健衛生大学 土田 邦博 教授と協力してカーボンナノホーン(CNH)と光感受性物質とタンパク質の3者複合体を作製し、マウスの腫瘍に対してレーザー光照射による顕著な光線力学治療(PDT)効果と光温熱治療(PHT)効果を確認した。
CNHというグラファイトシート一枚でできたナノサイズのチューブ(ツノ形状の先端、太さ2-5 nm, 長さ40-50 nm)に、光感受性の亜鉛フタロシアニン(ZnPc)と親水性タンパク質(BSA)を結合して、3者の複合体ZnPc-CNH-BSAを作製した。
この3者複合体は、光照射によってZnPcが活性酸素を発生して周りのがん細胞を死滅させ、CNH自体も光を吸収して温度上昇するので周りのがん細胞を死滅させる。マウスの皮下に移植した腫瘍に3者の複合体を注射し、赤色レーザー光を照射したところ、腫瘍はほぼ消滅した。CNHの効果が動物実験で確認されたのは世界初である。
本研究成果は、2008年9月22日から26日(米国東部時間)の間に、米国科学アカデミー紀要(Proceedings of the National Academy of Sciences USA, PNAS)のオンライン版に掲載される予定。
 |
|
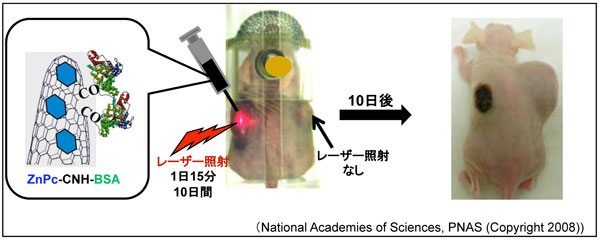
マウスの左右わき腹に皮下移植した腫瘍にZnPc-CNH-BSAを注射し、左側の腫瘍には赤色レーザー光を毎日15分ずつ10日間照射し、右側には照射しなかった。その結果、左側の腫瘍は消滅し、(黒い点は、レーザーによるやけど)、右側の腫瘍は日ごとに大きくなった。
|
薬剤を患部に届けるドラッグデリバリーシステム(DDS)開発では、ポリマーミセルやリポソーム運搬体などがよく研究されており、実用に供されているものも少なくない。しかし、一般的に、患部に到達する効率が低いという問題をかかえており、ナノマテリアルが、新規運搬体として関心がもたれているのも、患部への到達効率を改善できるかもしれないという期待によるところが大きい。
ナノマテリアルには、球形状ナノ粒子と円筒状のナノチューブに代表され、前者では様々な材質のものがある一方で、後者は炭素質のものが代表的である。円筒状炭素材の場合には内部空間に薬剤を貯蔵できるのでDDS素材として有望であると考えられ、これまでに多数の研究発表がなされているが動物実験で効果が確かめられたことはない。
産総研ではこれまで両端が開いた円筒状構造のカーボンナノチューブについては、その作製と利用について数多くの研究成果を発表してきたが、カーボンナノホーン(CNH)(ツノ形状先端、太さ2-5 nm, 長さ40-50 nm)についても製造と燃料電池などへの応用について研究を行っている。
CNHはさまざまな薬物を内部に包接できる構造をしているのでDDS運搬体として、我々は早くから着目していたが、これまでの種々の動物実験や細胞実験から、CHNは生体への短期毒性が極めて低いことを確認している。
本研究の主な部分は、湯田坂らにより、独立行政法人 科学技術振興機構(JST)戦略的創造研究推進事業 発展研究(SORST)の研究課題「カーボンナノチューブの特異な吸着現象-水素吸蔵とバイオテクノロジーへの応用-」の一環として2003年から2007年に行われた。また、JSTは本研究を、日本電気株式会社(NEC)、および、動物実験を担当した学校法人 藤田学園 藤田保健衛生大学と共同で行った。2008年4月からは産総研においてこの研究を発展させた。
腫瘍に対して光線力学治療(PDT)という治療法が一部で臨床応用されている。PDTでは腫瘍組織内に光感受性物質を集積させ、レーザー光線を照射して活性酸素を発生させ、腫瘍細胞を死滅させる。光感受性物質としては、ポルフィリンがよく用いられている。
本研究ではセラピーウインドーと呼ばれている皮膚透過性の高い600-700nmの波長の光をよく吸収するため、ポルフィリンよりPDT効果は高いと期待されている亜鉛フタロシアニン(ZnPc)を用いることを検討した。
我々はパイ電子に富むZnPcはグラファイトパイ電子系と強い相互作用をすると考え、グラファイトからなるCNHをZnPcの運搬体として用いる案を得た。CNHの一部を開孔すると内面と外面両方にZnPcが吸着し、内部空間にZnPcを貯蔵し、高効率の運搬体となりうると考えられた。
一方、CNH自体も、紫外から近赤外の広い波長範囲にわたって光を吸収して、局部的に温度が上昇して周りの細胞を死滅させる光温熱治療(PHT)効果を期待できる。従ってZnPc-CNHは、光照射により、PDTとPHTのダブル効果を発揮することが期待された。最大の難関は、ZnPcもCNHも水に溶けないため、生体内で使えないという点であった。しかし、これは、BSAタンパク質のような水溶性物質でCNHの外面を化学修飾することによって解決することができた。
 |
|
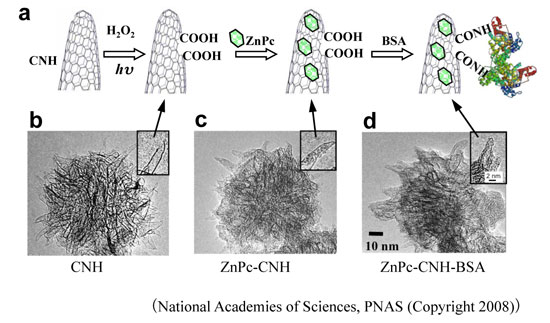
図1a. ZnPc-CNH-BSAの作成プロセス。b-d.各段階で得られたものの透過電子顕微鏡写真。挿入写真は、CNH1個の先端の拡大写真。bでは、開孔している先端が見えている。cでは、ZnPcが内部に入り込み、あるいは、外面に付着しているのがわかる。dでは、CNH集合体の外表面全体がBSAにより覆われている。(CNHはダリアの花弁状の集合体になっている。)
|
ZnPc-CNH-BSA複合体は、次のような手順により作製した。まずCNHに光照射しつつ過酸化水素水中で80℃に加熱すると、ホーンの一部が開孔する。この光照射酸化で効率よく開孔でき、かつ開孔縁に親水性の反応基であるカルボキシル基(-COOH)が多くできる。これとZnPcを溶媒中で混合して、CNHへZnPcを内包させた。次に、得られたZnPc-CNHとタンパク質BSAを反応させた。CNHのカルボキシル基(-COOH)とタンパク質BSAのアミノ基(-NH2)が反応し、アミド結合(-CONH-)を介して両者が結合する。このようにして、3者複合体ZnPc-CNH-BSAを作製した。
マウスの両わき腹の皮下に腫瘍を移植し7日経過した後、3者複合体ZnPc-CNH-BSAを両わき腹の局所に注射し、以後10日間、毎日15分、左側の腫瘍にのみレーザー光を照射した。レーザーは赤色ダイオードレーザー(波長670 nm)で出力160 mW(ビーム直径 5mm)である。
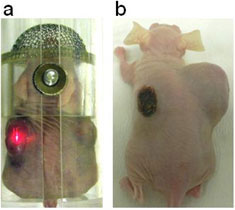 |
図2a:マウスの両わき腹に腫瘍を皮下移植後7日目のマウスに3者複合体ZnPc-CNH-BSAを局所注射した。(赤色はレーザー光の色)
図2b:以後、毎日15分、左側の腫瘍にのみレーザー照射をした。赤色レーザー光照射10日で左側の腫瘍が消えた。レーザー照射しなかった右側の腫瘍は、肥大化が顕著であった。(左わきの黒色化は、レーザー照射によるやけどである。)
|
 |
その結果、約10日後には、腫瘍が消滅した(図2b)。光照射を止め、数日おいても、再発はみられなかった。
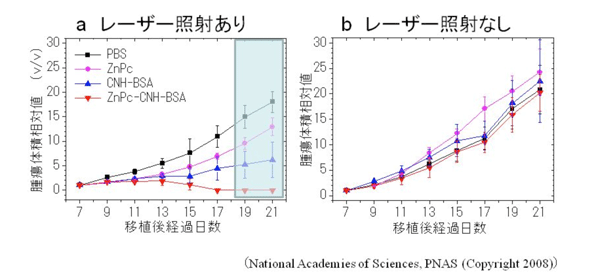
ZnPcのみ、あるいはCNHのみを投与した場合でも、レーザー照射によってある程度の抗腫瘍効果は認められたが、腫瘍消滅には至らなかった(図3a)。また、コントロール(PBS:リン酸緩衝液)のみを投与した場合も、レーザー照射による効果は認められなかった(図3a)。レーザー照射しないと、全ての場合において腫瘍サイズは日ごとに大きくなった(図3b)。
 |
|
図3a:レーザー照射の効果:コントロール(PBS)投与に比べて、ZnPc投与あるいは2者の複合体CNH-BSA投与でも、腫瘍増大がある程度抑えられた。3者複合体ZnPc-CNH-BSAでは、腫瘍は消滅し、腫瘍サイズは17日目ごろからゼロとなった。レーザー照射を止めた19-21日においても、腫瘍の再発は見られなかった。
図3b:レーザー照射しない場合:全ての場合において腫瘍サイズは日ごとに大きくなった。
|
今後、大学や企業との協力によって、静脈投与でも使えるように、BSA以外の化学修飾を検討し、カーボンナノホーン集合体のサイズ制御も検討して、実用化を目指したい。