国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)ナノ材料研究部門【研究部門長 佐々木 毅】 湯田坂 雅子 招聘研究員と片浦 弘道 首席研究員は、国立研究開発法人 国立国際医療研究センター【理事長 國土 典宏】研究所 疾患制御研究部 幹細胞治療開発研究室 佐伯 久美子 室長、国立大学法人 北海道大学【総長 名和 豊春】大学院獣医学研究院 基礎獣医科学分野 岡松 優子 講師 らと共同で、リン脂質ポリエチレングリコール(PLPEG)で表面を被覆した単層カーボンナノチューブ(SWCNT)を近赤外蛍光(NIRF)プローブとして用いて、マウス全身のNIRF造影と今回開発したNIRF顕微鏡による組織観察を行った。その結果、絶食させたマウスではSWCNTが褐色脂肪組織(BAT)に集積する現象を発見した。また、それが、BATの血管壁透過性が亢進してSWCNTが血管外に漏出するためということを見出した。
SWCNTのNIRFを利用したマウス全身造影とNIRF顕微鏡による細胞レベルでの組織観察は、臓器・組織の異常発見とその機序解明に役立ち、薬剤や治療法の開発への貢献が期待される。なお、この技術の詳細は、2018年9月27日にScientific Reportsにオンライン掲載された。
 |
|
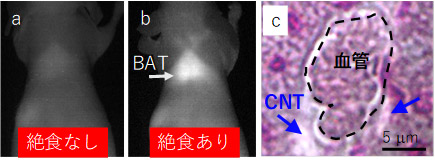
PLPEGで被覆したSWCNTを尾静脈に投与したマウスの(a、b)BAT部分のNIRF造影像と(c)絶食マウスのBATのNIRF顕微鏡像
絶食マウスではBATにSWCNTが集積して明るく造影され(b)、SWCNTはBATの血管外に漏出している(c)。正常マウス(絶食なし)では、BATにSWCNTは集積せず、明るく造影されない(a)。 |
生体組織の細胞レベルでの異常(細胞死、がん細胞浸潤など)の把握は、疾病治療法の研究開発にとって重要であるが、従来の造影剤では分子サイズが小さいため、組織にとどまる時間が短く、解剖して得た組織から異常を読み取ることが困難である。また、その場で観察できる手法が探索されているが、生きた動物から微視的な情報を得ることも、動物が呼吸などにより動くため難しい。
このような中、近赤外光の生体透過性の高さを生かし、近赤外蛍光ナノ物質を用いた生体内造影研究が近年注目を集めている。中でもSWCNTは他の近赤外蛍光ナノ物質と異なり、退色しにくく、毒性も低いため、動物実験を用いた医療関連研究への貢献が期待されている。 また、SWCNTは直径約1 nm、長さ約数十 nm~数 µmと大きいため、組織内にとどまる時間が長く、解剖後の組織観察により異常を発見しやすいと考えられている。さらに、SWCNTの蛍光は、組織の自家発光と波長が異なるため、鮮明なNIRF像が得られる。
産総研は、SWCNTのバイオ分野での実用化を目指して研究開発に取り組んでいる。特に、SWCNTを使った動物実験用の近赤外蛍光プローブや生体応用に適したSWCNTの分散手法、酸化によりSWCNTの蛍光強度を増大させる技術などを開発してきた(2018年4月19日 産総研プレス発表)。また、MPCポリマーの一種であるPMBで表面を被覆したSWCNTを用いるとマウスBATを選択的に造影でき、他の褐色脂肪組織造影剤より鮮明で正確な画像が得られることを明らかにした(2017年3月17日 産総研プレス発表)。
これまで、血管や臓器など大きな部位を造影するための近赤外蛍光プローブとしてのSWCNTの研究開発を行ってきたが、今回、SWCNTを近赤外蛍光プローブとして用いて、細胞レベルでの微視的情報を得る技術の開発に取り組んだ。
なお、今回の研究開発は、独立行政法人 日本学術振興会の科学研究費助成事業 基盤研究(A)「カーボンナノチューブによる褐色脂肪組織の近赤外光造影(平成28~30年度)」、基盤研究(S)「完全制御カーボンナノチューブの物性と応用(平成25~29年度)」による支援を受けた。
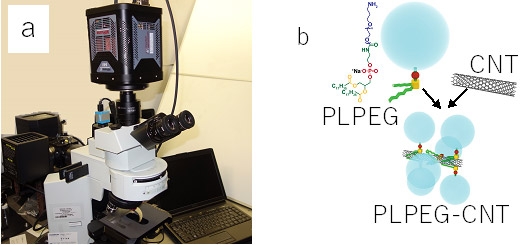
これまでSWCNTを用いたマウス体内のNIRF造影では、血管や臓器など比較的大きく肉眼でも見分けられる部位を非侵襲的に造影してきた。しかし、組織内の微視的な異常の情報は得られず医療研究への適用には限界があった。組織内のSWCNTの微視的な分布を細胞レベルで観測するには、近赤外光に対応した光学素子を用いたNIRF顕微鏡が必要である。近年、近赤外光の有用性が知られるにつれ、近赤外光対応の光学素子の開発が進んできたため、今回、近赤外対応対物レンズとCNT励起・観察用ダイクロイックミラー、そして高感度2次元NIR検出器を組み合わせ、空間解像度を数µm程度にあげたNIRF顕微鏡を開発した(図1a)。また、疎水性のSWCNTに親水性を持たせることで、マクロファージに捕獲されないようにPLPEGで表面を被覆したSWCNT(PLPEG-SWCNT)を近赤外蛍光プローブに用いた(図1b)。このPLPEG-SWCNTは水溶液中でほぼ孤立分散する。
 |
|
図1 今回開発した(a)NIRF顕微鏡と、(b)プローブに用いたPLPEG-SWCNT |
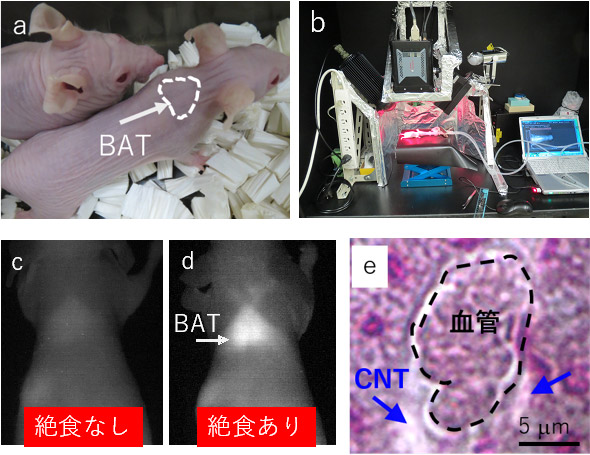
PLPEG-SWCNTをマウスに尾静脈投与し、マウスの全身、特にBAT(図2a)を2016年に産総研が開発したNIRF造影装置(図2b)を用いて全身撮影した。この撮影では波長1000 nm以上の蛍光を検出した。正常マウスでは、PLPEG-SWCNTはBATに蓄積せず、NIRF撮影では明るく造影されなかったが(図2c)、マウスを絶食(20時間)させると、何らかの理由でPLPEG-SWCNTがBATに蓄積され、明るく造影された(図2d)。
CNTがBATに蓄積される機序を明らかにするため、PLPEG-SWCNTが蓄積した絶食マウスのBATの組織を今回開発したNIRF顕微鏡(図1a)で波長1100 nm以上の蛍光を観察すると、BATの血管からPLPEG-SWCNTが漏れ出て、組織内に拡散していた。絶食によりBATの血管壁透過性が亢進するこの現象はPLPEG-SWCNTによって初めて捉えられた現象である(図2e)。他に、同様の機能を持つプローブは見当たらず、PLPEG-SWCNTは細胞レベルでの異常を検知するのに優れたプローブであるといえる。さらに詳細に調べるため、BATを鍍銀染色し通常の光学顕微鏡や電子顕微鏡で観察したところ、BATで細胞や血管を支えて組織を形作っている結合組織であるコラーゲン線維が脆弱化していることがわかった。絶食マウスのBATでは、コラーゲン分解酵素の1つであるMMP3の発現が亢進していたことから、絶食によるBATの血管壁透過性亢進は、血管を裏打ちしているコラーゲン線維の脆弱化に起因すると推察される。
今回、PLPEGを被覆剤として用いたが、PLPEGに含まれるポリエチレングリコールは生体親和性がよいためPLPEG-SWCNTの免疫系細胞による捕獲を阻止できる。また、タンパク質などの非特異的吸着も避けられるためプローブのサイズが大きくなることもなく、体中の毛細血管にくまなく到達する。そのため、血管異常を伴う異常であれば、どこで起こってもPLPEG-SWCNTを使って場所を特定でき、さらに異常原因を明らかにして適切な治療を施せる可能性がある。また、組織内の細胞レベルでの微細な構造変化が検知できるため、PLPEG-SWCNTを用いた体内のNIRF造影と組織のNIRF顕微鏡観察が、未知の生体組織の微細な構造変化の発見や、その生理的意義の解明に貢献できる可能性がある。
 |
|
図2 (a)マウスのBAT部分、(b)NIRF造影装置、(c、d)撮影したNIRF像、(e)撮影したNIRF顕微鏡像 |
今後はNIRF顕微鏡を改良し、PLPEG-SWCNTの細胞レベルでの微細分布解明の精度を高める。また、がん治療研究に役立つことを目指して、腫瘍構造の細胞レベルでの解明に今回開発した技術を適用していく。