独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)バイオメディカル研究部門【研究部門長 近江谷 克裕】 シグナル分子研究グループ 浅田 眞弘 主任研究員、今村 亨 研究グループ長らは、独立行政法人 放射線医学総合研究所【理事長 米倉 義晴】明石 真言 理事、重粒子医科学センター・先端粒子線生物研究プログラム【プログラムリーダー 今井 高志】中山 文明 主任研究員らと共に、高線量の放射線被ばくによる障害の予防・治療に効果があるとみられる新たな細胞増殖因子FGFCを創製した。
これまで放射線被ばくによる個体死の抑制に有効な薬剤はあまりなかった。産総研では安定性の高い新たな細胞増殖因子FGFCを創製し、今回、マウスによる実験で高線量の放射線被ばくによる生命への重篤な影響に対するFGFCの効果を調べた。その結果、FGFCを投与したマウスは、事前投与だけでなく事後投与でも、生存日数が延長し、FGFCが致命的な放射線障害に対する予防・治療に有効である可能性が示された。今後は安全性など詳細な評価を行いたいと考えている。
この成果の詳細は、平成24年9月6~8日に、国立大学法人 東北大学(宮城県仙台市)で開催される日本放射線影響学会第55回大会にて発表される。
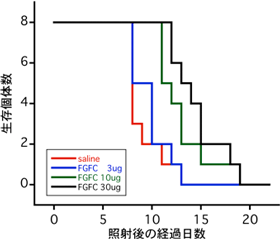 |
FGFCを腹腔内投与し、その24時間後に 8 グレイ(Gy)のX線を全身照射したマウスの生存曲線
赤線は生理食塩水だけを投与した場合。青線はFGFCを3 μg、緑線はFGFCを10 μg、黒線はFGFCを30 μgそれぞれ投与した場合。 |
2011年3月の東京電力福島第一原子力発電所の事故以降、放射線障害を予防・治療する方策の必要性が広く社会に認識されている。しかし、これまで、治療薬としては甲状腺への放射性ヨウ素の蓄積を阻害するヨウ化カリウムや、白血球数の低下を防止し合併症を防ぐ目的のG-CSFなどしか知られていなかった。
米国で放射線療法に伴う口腔粘膜炎の治療薬として承認されているパリフェルミン(組み換えヒト角化細胞増殖因子FGF7。日本では未承認。)は、繊維芽細胞増殖因子(FGF)ファミリーの一員である。しかし、上皮細胞にだけ作用を示すなど作用範囲(標的細胞特異性)は限定的で、またこの因子そのものが不安定であるため煩雑な反復投与が求められている。
このような状況から、より安定で適用範囲の広い放射線障害の予防・治療薬の開発が待ち望まれている。
産総研では細胞や個体の働きを制御するシグナル分子の機能を明らかにし、新たな診断・治療・創薬のターゲット分子の同定や治療法への応用を目指している。近年、放射線障害の予防・治療薬の必要性が広く認識されていることから、高線量放射線被ばくによる障害の予防・治療に向けた細胞増殖因子の研究を推進してきた。これまでに、FGF1、FGF7、FGF10が、X線照射後のマウス空腸の生存クリプト数が減少するのを抑え、骨髄におけるアポトーシスマーカー出現を抑える効果をもつことを確認した。また、FGF1と類似の生物特性をもつが、構造的にFGF1よりも安定したFGFC(FGF1とFGF2の最適化キメラ分子)を創製した。
今回、FGFCの放射線障害の防護剤としての有効性を検証する一環として、高線量の放射線被ばくによるマウス個体の生存率に対する効果を検討した。
また、今回の実験は、産総研 動物実験委員会の審査・承認を経て行われ、動物実験・実験動物取扱ガイドラインに準拠している。
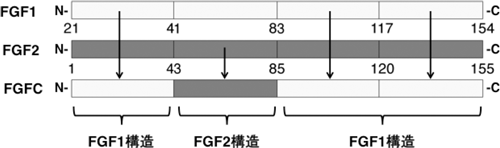
FGFの活性は主に、標的となる細胞表面のFGF受容体を介して細胞内に伝達されるため、生理的な活性は、FGF自身の発現制御と、対応する複数種のFGF受容体や補助受容体の発現制御によって決まる。パリフェルミン(角化細胞増殖因子;FGF7)は上皮細胞に特異的であり、褥瘡(じょくそう)治療薬として認可されているトラフェルミン(塩基性繊維芽細胞増殖因子;FGF2)は真皮細胞に特異的に作用する。一方、酸性繊維芽細胞増殖因子;FGF1は広範な細胞に作用するが、活性を示すためにはヘパリンなどの糖鎖が必須である。そこで、産総研では、FGF1とFGF2の一部を入れ替えたキメラ分子を数種類作成した。それらのうち、広範な細胞に作用し、増殖にヘパリンを必要としない細胞増殖因子FGFC(図1)は、耐酸性やタンパク質分解酵素に対する抵抗性、吸着性といった点でも、これまでのFGFにはない特性をもっていた(表1)。
 |
|
図1 FGF1およびFGF2、FGFキメラタンパク質(FGFC)の模式図 |
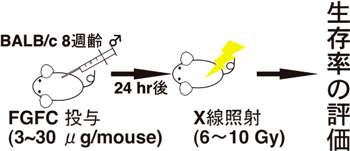
今回、このような優位性をもつFGFCについて、放射線障害の防護剤としての有効性を検証する一環として、高線量の放射線被ばくによる個体の生存率に対する効果を調べた。BALB/c マウス(約8週齢、オス、一群8匹)の腹腔内にFGFCを投与し、その24時間後にX線を全身照射した。そして、個体の生存率の時間変化を測定した(図2)。
 |
|
図2 実験方法の模式図 |
X線の照射線量とFGFCの投与量の、生存率への影響を調べた結果、X線照射の24時間前にFGFCを投与すると、8 GyのX線照射の場合、3 µg~30 µgの範囲で、投与したFGFCの量が多いほどX線照射後の生存日数が延びた(図3)。また、6 GyのX線照射の場合には、生理食塩水だけを投与したマウス群は照射後30日までに38% が死亡するのに対し、30 µgのFGFCを投与したマウス群では全ての個体が生存した。一方、10 Gyの照射では、有意な効果は認められなかった。
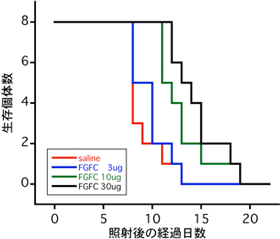 |
図3 FGFCを腹腔内投与し、その24時間後に 8 GyのX線を全身照射したマウスの生存曲線
赤線は生理食塩水だけを投与した場合。青線はFGFCを3 μg、緑線はFGFCを10 μg、黒線はFGFCを30 μgそれぞれ投与した場合。 |
次に、放射線被ばく後の投与、すなわち、被ばく後の治療薬としての効果を検討した。X線照射の2時間後、24時間後にFGFCを投与し、生存率への影響を調べた。6 Gy照射したマウス群では、照射2時間後、24時間後のいずれの投与によっても、生存率の向上が認められた(図4)。しかし、8 Gy、10 Gy照射群では、有意な効果は認められなかった。
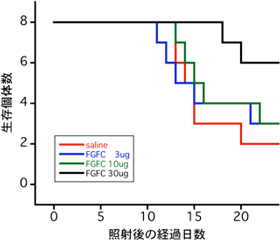 |
図4 6 GyのX線を全身照射し、その2時間後にFGFCを腹腔内投与したマウスの生存曲線
赤線は生理食塩水だけを投与した場合。青線はFGFCを3 μg、緑線はFGFCを10 μg、黒線はFGFCを30 μgそれぞれ投与した場合。 |
以上のように、放射線被ばくの線量、FGFCの投与量および投与時期がある範囲内にあれば、FGFCの投与による予防・治療が有効である可能性が示された。
今後は、FGFCの作用メカニズムをより詳細に解析すると共に、投与回数や他の処置との併用などを検討し、その効果を最大限利用できる方法を確立したいと考えている。また、安全性などの評価も行っていく予定である。