独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)ナノチューブ応用研究センター【研究センター長 飯島 澄男】有機ナノチューブ材料チーム 亀田 直弘 研究員は、変性したタンパク質を正常な立体構造へと折り畳ませて(リフォールディング)、本来の活性を回復させる有機ナノチューブゲルを開発した。さらに、この有機ナノチューブゲルはタンパク質を熱や化学物質から保護することができる。
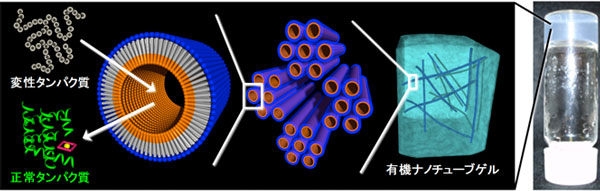
この技術は、対象のタンパク質にあわせて、内外表面の構造やナノチャンネルの径を精密に制御した有機ナノチューブゲルの形成によって実現できた。有機ナノチューブゲルを形成する過程で変性したタンパク質を包接させ、pH変化を利用した有機ナノチューブゲルからの回収操作によって、活性が回復したタンパク質だけを高純度で得ることができる。有機ナノチューブをゲルの担体として扱えるため、ろ過や遠心分離操作をすることなく、水洗浄による変性剤の除去や目的タンパク質の分離回収を簡便に行える利点がある。さらに、有機ナノチューブ内部のナノチャンネルにタンパク質を包接させると、加熱や高濃度の変性剤によっても、タンパク質の活性が失われない。この技術により、高純度タンパク質の効率的な調製への活用、さらには有機ナノチューブに酵素を複合化してナノリアクターや酵素センサーへの活用も期待される。
なお、この研究成果の詳細は、2012年5月23日(日本時間)にアメリカ化学会の学術誌ACS Nanoにオンライン公開される。
 |
|
図1 有機ナノチューブゲルのナノチャンネルを利用した変性タンパク質から正常タンパク質への折り畳み(リフォールディング) |
生体内の化学反応を特異的かつ高収率・高選択に進行させる酵素が、化学工業分野における省エネルギー・環境低負荷型の触媒として、グリーンイノベーションの観点から大きな注目を集めている。酵素はタンパク質であり、構成成分であるアミノ酸の相互作用により、一定の立体構造に折り畳まれ、その形態に基づいて触媒機能を示す。タンパク質の調製には、大腸菌を用いた組み換え技術が工業的にも広く用いられている。しかし、組み換えタンパク質の発現過程で、正常な立体構造から大きく変化し、触媒機能を失活した変性タンパク質の凝集体が生じてしまう。この凝集体から、正常な立体構造と本来の触媒機能をもったタンパク質を回復させる効率は極めて低い。そのため、凝集の抑制や正常な立体構造への折り畳み(リフォールディング)の補助をするさまざまな添加剤が開発されたが、収率や汎用性が低い。
一方、生体系では、変性タンパク質を取り込んで隔離し、リフォールディングを補助するナノ空間をもつ分子シャペロンと呼ばれるタンパク質群がある。近年、分子シャペロンを模倣できる多孔質無機体や高分子ナノ粒子などが注目されている。しかし、タンパク質の多孔質無機体や高分子ナノ粒子からの脱離には添加剤が必要であり、目的タンパク質には、添加剤やリフォールディングが不完全なタンパク質などが共存する。そのため煩雑な分離操作が必要であり、分離操作によるタンパク質の再変性も懸念されている。
産総研は、過去10年以上にわたり、糖、アミノ酸、核酸、脂肪酸などの再生可能な天然由来物質から合成した両親媒性分子を液相中で自己組織化させて、ファイバー状の形態やチューブ状の形態(有機ナノチューブ)をもつ有機ナノ材料の開発に取り組んでいる。近年では、有機ナノチューブの大量製造法を確立し、さまざまな用途開発を推進している。
従来の二分子膜有機ナノチューブは、外側の表面と内側のナノチャンネル側の表面が同一の構造であるが、最近では分子設計や分子配列制御により、それぞれの表面の構造が異なっている単分子膜有機ナノチューブの構築にも成功している。ナノチャンネル側の表面を薬剤、タンパク質、DNA、ナノ粒子など(ゲストと呼ぶ)と相互作用できる構造にすることで、効率的で選択的なゲストの包接や、相互作用を外部から制御することでゲストの貯蔵と放出を制御できる。
今回、変性タンパク質をゲストとするように、表面の構造やナノチャンネルの径を精密に制御した有機ナノチューブゲルを構築し、タンパク質のリフォールディング促進や活性保護など新たな機能開拓を目指した。
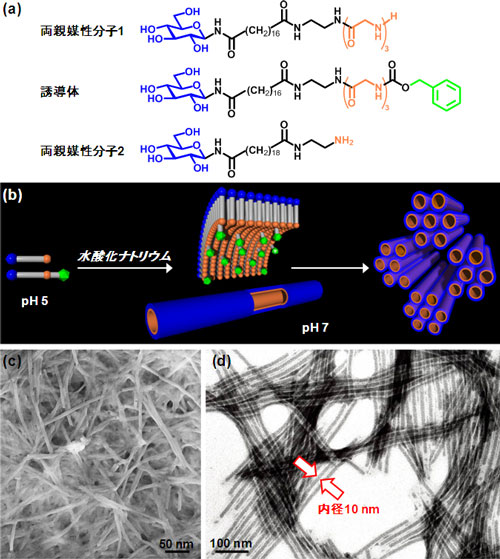
疎水性の部分が表面に露出した変性タンパク質は、水溶液中で凝集が起こりやすい。そこで、変性タンパク質を有機ナノチューブ内に効率よく包接し、凝集を抑制するため、ナノチャンネル側表面に疎水性の構造を導入した。図2aに示す両親媒性分子1と末端に疎水性のベンジル基(図2a、緑色の部分)をもつ誘導体を設計・合成し、この二つの成分を自己組織化させることで、両親媒性分子1と誘導体のモル比が9:1の有機ナノチューブゲル(L-10-NTG)を形成した。有機ナノチューブゲルの形成は、室温下で水酸化ナトリウムによりpHを調節することで行った(図2b)。なお、有機ナノチューブは両親媒性分子1 と誘導体が平行配列した単分子膜からなり、内径は10 nmであった(図2b、2c、2d)。比較のために両親媒性分子1だけの自己組織化により、有機ナノチューブゲル(H-10-NTG)を、また、両親媒性分子2だけの自己組織化により有機ナノチューブゲル(H-20-NTG、有機ナノチューブの内径は20 nm)を調製した。
 |
|
図2 (a)両親媒性分子と誘導体の化学構造式 (b)単分子膜からなる有機ナノチューブの模式図 (c)乾燥した有機ナノチューブゲルの走査型電子顕微鏡写真 (d)リンタングステン酸によりナノチャンネルを染色した有機ナノチューブの透過型電子顕微鏡写真 |
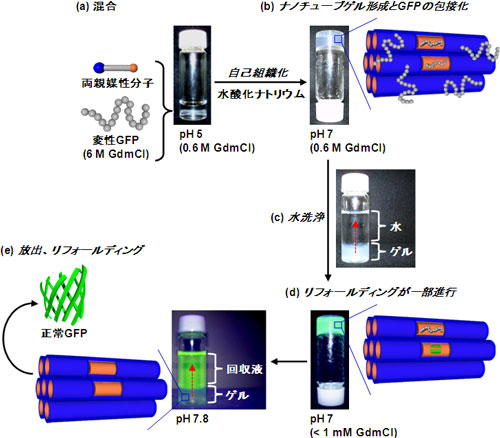
モデルタンパク質として緑色蛍光タンパク質(GFP、分子量約3万)を用い、塩酸グアニジン(GdmCl、濃度6 M)によって化学変性させた。L-10-NTGとH-10-NTGの自己組織化の際に変性GFPを共存させて、有機ナノチューブゲルの形成と同時に変性GFPをナノチャンネルに包接させた(図3a、3b)。5 mgのL-10-NTGに包接された変性GFP量は38 µgで、H-10-NTGによる包接量(13 µg)よりも約3倍多かった。これはL-10-NTG内部のベンジル基と変性GFP疎水性部分との疎水性相互作用によると考えられる。
変性剤GdmClの濃度を1 mM以下にするため、変性GFPを包接した有機ナノチューブゲルを水で洗浄したところ(図3c)、包接されたGFPの一部が蛍光活性を回復し(図3d)、ナノチャンネルにおいてリフォールディングが促進されていた。
 |
|
図3 変性剤で変性させたタンパク質のリフォールディングプロセス(GFPの場合) |
さらに回収溶液(pH 7.8のバッファー溶液)を添加すると、両親媒性分子1のナノチャンネル側表面にあるグリシンアミノ基が無電荷状態となってGFPとの静電相互作用が消失する。そのため、ナノチャンネルでのリフォールディングにより既に正常構造となったGFPだけでなく、ナノチャンネルでリフォールディングが不完全だったGFPもリフォールディングした状態で、有機ナノチューブゲルから回収できた(図3e)。包接したGFPの全リフォールディング率は、H-10-NTGで49%、L-10-NTGで85%であり、ナノチャンネルへの疎水性構造(ベンジル基)の導入により、特に放出・回収時のリフォールディングが強く誘起されていた(表1)。リフォールディングしなかった変性GFP(H-10-NTGで51%、L-10-NTGで15%)は有機ナノチューブゲルに包接されたままであり、特別な添加剤を使わなくてもリフォールディングしたGFPだけをpHを調節した回収溶液に選択的に回収できる。従来の希釈法によるGFPのリフォールディング率は14%であり、有機ナノチューブゲルによりリフォールディングが促進されることが明らかとなった。
|
表1 有機ナノチューブゲルや希釈法を用いた場合の変性タンパク質のリフォールディング率 |
 |
H-10-NTGは、GFPと同程度の分子量である炭酸脱水素酵素(CAB、分子量約3万)に対してはリフォールディング促進機能を示したが、分子量がより大きなクエン酸合成酵素(CS、分子量約10万)のリフォールディングを効率的に誘起できなかった(表1)。一方、有機ナノチューブの内径が20 nmであるH-20-NTGは、CSに対して高いリフォールディング促進機能を示すが、GFPとCABのリフォールディングは全く誘起できない。むしろ内部のナノチャンネルでそれらのタンパク質の凝集を促進した。これらから、個々のタンパク質に対して適切な内径サイズをもつ有機ナノチューブゲルが高いリフォールディング促進機能をもつことが分かった。
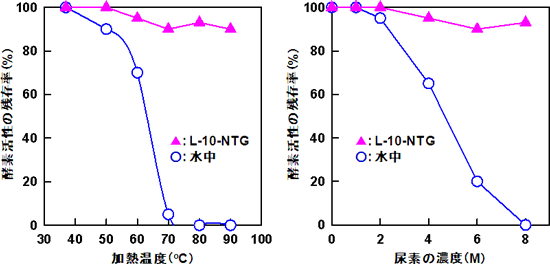
有機ナノチューブゲルは、リフォールディング促進機能のほかにタンパク質の熱変性や化学変性を強く抑制する保護機能をもっている。水中のフリーのCABは、加熱や高濃度の尿素(変性剤)によって熱変性や化学変性により酵素活性をほぼ完全に失うが、L-10-NTGのナノチャンネル内部に包接されたCABは、加熱や変性剤から保護され、同条件でも、90%近くの酵素活性を保持していた(図4)。
 |
|
図4 有機ナノチューブゲルに包接されたCABと水中のフリーのCABの熱安定性(左)および化学安定性(右)の比較 |
今後は、物性が異なる種々のタンパク質に対して、表面構造やナノチャンネルの径を適切に制御した有機ナノチューブゲル群を創製する。サンプル提供を含む共同研究によって人工分子シャペロンシステムの確立を目指す。また、酵素複合化有機ナノチューブのナノリアクターや酵素センサーへの応用展開も行っていく予定である。