独立行政法人 産業技術総合研究所【理事長 野間口 有】浅島 誠 フェローと幹細胞工学研究センター【研究センター長 浅島 誠】幹細胞制御研究チーム 桑原 知子 主任研究員、器官発生研究チーム 伊藤 弓弦 研究チーム長、小沼 泰子 研究員らは、米国ソーク研究所 Fred H. Gage教授らと共同で、ラットを用いた動物実験により、成体の神経幹細胞を膵臓に移植する糖尿病の再生医療に有効な方法を開発し、その治療効果を確認した。
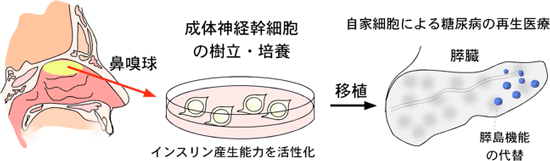
まず基礎研究過程で、神経細胞は膵臓細胞と同じように、本来はインスリンを産生する能力を持っていること、および、その活性化のメカニズムを明らかにした。神経細胞の元となる成体の神経幹細胞は、困難な手術を伴う脳内からだけでなく、比較的採取が簡単な鼻嗅球からも樹立・培養することができる。そこで、糖尿病ラットから成体神経幹細胞を採取・樹立し、インスリンを産生しやすい状態に導いてから糖尿病ラットの膵臓に移植すると、継続的な血糖値低下をもたらすことを確かめた。遺伝子導入などを行わずに、自家細胞を用いて、より安全で自然な再生医療へとつながる可能性がある。
なお、この成果の詳細は、欧州の学術誌EMBO molecular medicine誌に掲載される。
 |
|
図1 自家細胞による糖尿病の再生医療の概念図 |
近年、わが国の糖尿病患者数は著しく増加しており、糖尿病予備軍を含めると1,000~2,000万人に及ぶと言われている。発症後、多くの糖尿病患者が網膜症や腎症などの合併症を併発する重症化を引き起こすため、糖尿病に対する根本的な治療法の確立が重要課題の一つである。
Ⅰ型糖尿病の治療方法として、他人の膵臓からの膵島(ランゲルハンス島)移植は効果があるが、消化酵素で満たされている膵臓特有の性質から、提供可能者を生前から探索し、適合性を確認するといった準備をしておかないと移植可能な膵臓が入手できない。そのため、膵島移植医療のドナー不足の問題は非常に深刻である。また、移植後も免疫抑制剤の併用が必要となるため高額な医療費負担や、免疫抑制剤による代謝作用の低下といった問題もある。膵島移植に代わる移植治療法として、幹細胞移植があるが、移植に用いる幹細胞を、いかに効率よく安全に用意できるかが課題となっている。移植後の患者の長期にわたる生活の安定のために、将来がん化などを引き起こしかねない遺伝子導入などの操作を行わず、移植先の臓器に順応する性質を持つ、より安全な幹細胞が求められている。
産総研では、これまで脳内にある神経幹細胞を解析し、アルツハイマー病やうつ病の医療・創薬開発に役立てるための研究を行ってきた。その過程で、成体神経幹細胞が膵臓の分化制御因子群に非常に類似していることに着目し、さらに詳しいメカニズムについて解析してきた。これは、神経幹細胞を膵臓で機能する細胞の代替として利用する技術につながり、糖尿病や膵臓疾患の再生医療に役立つ可能性があったからである。米国ソーク研究所では成体神経幹細胞の最先端の研究が行われているが、同研究所のFred H. Gage教授と共同で、成体の脳海馬や、より採取しやすい鼻嗅球から樹立された成体神経幹細胞を用いて、その特性や能力について詳細な解析を行ってきた。
この研究は、独立行政法人 日本学術振興会科学研究費補助金(若手研究B)と、財団法人 医科学応用研究財団の支援を受けて行ったものである。
成体の脳内には、神経新生を起こしている神経幹細胞が存在する。近年、成体期の鼻嗅球にも神経幹細胞が存在し、神経新生を起こしていることがわかってきた。成体の神経幹細胞についての基礎的な研究の過程で、インスリンを産生するために必要な遺伝子が、成体の膵臓と脳の神経系で共通して発現していることを見出した。自家細胞を採取して移植用の細胞源として用いる再生医療への応用を考えると、困難な手術を伴う脳内の神経幹細胞よりも、内視鏡などを用いて鼻嗅球から神経幹細胞を採取・樹立する方が望ましい。
そこで、成体神経幹細胞をラットの脳の海馬と鼻嗅球の両方から樹立・培養し、インスリン産生に必要な遺伝子や、分化に重要な遺伝子などがどのように発現されるかについて、マイクロアレイ法などを用いて遺伝子の発現比較解析を行った。その結果、海馬由来、鼻嗅球由来どちらの神経幹細胞でも、神経細胞に分化する過程でインスリンを産生する遺伝子が発現することがわかった。
糖尿病のラットの脳海馬と鼻嗅球から、それぞれ神経幹細胞を樹立して、実際に移植の効果を調べた。これらの神経幹細胞をインスリンの産生能力を促進させる薬剤を添加した細胞培養液中で2週間培養した後、糖尿病ラットの膵臓に移植した。糖尿病の病態を表す血糖値を定期的に測定したところ、海馬由来と鼻嗅球由来のどちらの神経幹細胞を移植した系でも、糖尿病ラットの血糖値が徐々に減少し、糖尿病の病態が改善された。なお、神経幹細胞を移植しなかった糖尿病ラット群は8週間後(図2、*印)には、病態が顕著に悪化し死亡した。さらに、病態が改善した糖尿病ラットから移植した神経幹細胞を除去したところ(図2、点線矢印)、血糖値が再び上昇した。
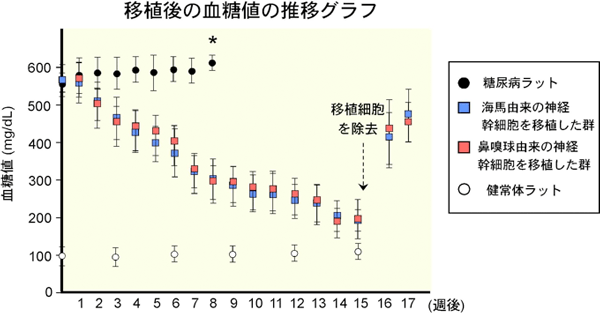 |
図2 糖尿病ラットに、糖尿病ラット由来の成体神経幹細胞を移植した場合の治療効果
(16週目以降は、移植細胞を除去した結果) |
さらに、成体神経幹細胞の移植後15週間経過した糖尿病ラットの膵臓で、インスリンがどの細胞から産生されているかを抗体染色で調べた。移植した成体神経幹細胞と糖尿病ラット由来の細胞を識別するために、移植細胞は緑色蛍光タンパク質(GFP)をマーカーとして発現するようにしてある。糖尿病ラットの膵臓の膵島では、インスリンはほとんど産生されていないが、対照的に、移植した神経幹細胞(図3、緑の細胞)からは、効率よくインスリンが産生されていることが確認された。
これらの結果は、糖尿病ラットの脳海馬や鼻嗅球から樹立した神経幹細胞が、移植された膵臓内でインスリンを産生することにより、糖尿病の病態が改善されたことを示している。
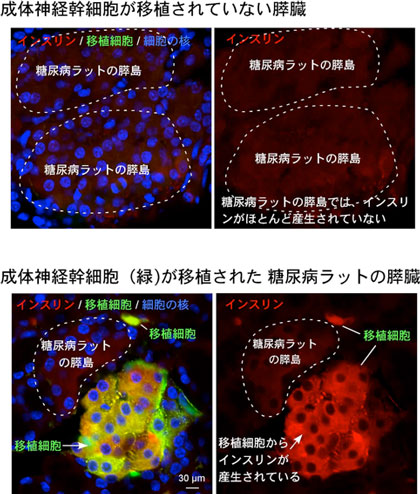 |
図3 移植された成体神経幹細胞がインスリンを産生している様子
(緑:移植された鼻嗅球由来の神経幹細胞、赤:インスリン産生) |
今回開発した技術は自家細胞(鼻嗅球からの成体幹細胞)の移植なので、ドナー問題はなく、免疫抑制剤による副作用の心配もないため、より自然な再生医療につながると考えられる。インスリンを産生する細胞が継続的に成体神経幹細胞から補充され、治療効果が長く持続する。また、遺伝子導入過程を一切含まないのでがん化などのリスクが低く、安全性が高いのも利点の一つである。重度の合併症(網膜症や腎症)を引き起こす前段階の予備治療としても利用でき、可能となる治療対象は幅広いと考えられる。
成体の神経幹細胞でインスリンが産生されるメカニズムの解析から得られた知見をもとに、神経細胞そのものに与える影響や、より効果的なインスリン産生能力の活性化薬剤の探索にむけた研究開発を行う予定である。