独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)生物機能工学研究部門【研究部門長 織田 雅直】分子細胞育種研究グループ 本田 真也 研究グループ長らは、分子デザインにより、抗体の精製に用いるタンパク質を改変し、その安定性と親和性を向上させることに成功した。
研究対象としたのは、各種の抗体の定常領域に親和性をもつプロテインGで、分子をデザインして改変することにより、耐熱性、化学薬品耐性、酵素分解耐性、抗体との親和性、pH応答性など、抗体の精製時に重要となる特性が向上した。プロテインGはこれまでも実験室レベルの抗体精製に用いられてきたが、今回の分子デザインによる改変によって耐久性が向上し、また、穏やかな条件での精製が可能になったため、抗体の工業的な製造用途にも適合できるようになった。今後、抗体医薬を製造する際の精製工程での利用が期待される。
本成果の詳細は、2010年3月24日~26日に中国北京市で開催される第2回国際抗体会議(ICA 2010)において、2010年3月25日(現地時間)に発表される。
 |
|
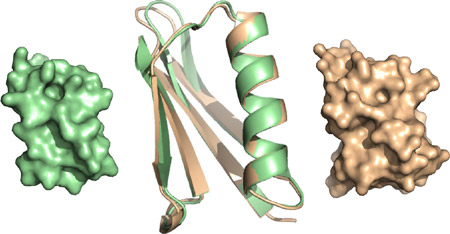
図 X線結晶解析により決定した改変プロテインGの立体構造(右、橙)と、天然由来である改変前のプロテインGの立体構造(左、緑)の比較
両方の立体構造の重ね合わせ(中央)から、分子の骨格構造は改変前とほとんど変わっていないことが確認できる
|
抗体医薬は、従来の低分子の医薬と比べて、薬効が高く、副作用が少ないことから、開発成功率が高いなどの特徴があり、年平均50パーセント前後の高い伸び率で利用が拡大している。現在、国内の市場規模は1,300億円に達するが、抗体医薬の価格の高さに社会的な関心が集まるようになり、製造コストを低減する技術の誕生が期待されている。
抗体医薬製造工程のうち、もっともコストがかかるのが精製工程で、その精製コストの半分以上がアフィニティークロマトグラフィー(親和性により目的物を分離精製する方法)工程によるものである。アフィニティークロマトグラフィーは抗体医薬の純度を上げ品質を保証するために必須の工程であり、認可済みの医薬のほとんどで、抗体の定常領域(分子構造上の共通部分)に親和性をもつ、微生物由来のタンパク質であるプロテインAがアフィニティーリガンド(親和性をもつ分子)として利用されている。プロテインAは抗体のみを特異的に認識し結合するなど優れた特性をもつが、精製コスト上昇の主な原因でもあることから代替する分子の開発が望まれている。
産総研では、タンパク質の特性を目的に合わせて改変するための分子デザイン技術の開発を行ってきた。これまで、わずか10残基のアミノ酸で固有の立体構造を形成し協同的な構造転移を示す“最小のタンパク質”シニョリンの設計(2004年8月10日プレス発表)やその分子の安定化改変と結晶構造の解明(2008年10月27日産総研ホームページ「主な研究成果」記事)を発表してきている。
今回、独自に開発した分子デザインプログラム等を活用して、抗体の定常領域に親和性をもつタンパク質プロテインGを改良して、耐熱性、化学薬品耐性、酵素分解耐性、抗体親和性、pH応答性の優れた改変タンパク質を開発することとした。
なお、本研究成果の一部は、独立行政法人 新エネルギー・産業技術総合開発機構(NEDO)の委託事業「新機能抗体創製技術開発/高効率な抗体分離精製技術(平成18~22年度)」により得られたものである。
ヒトにはいくつかの種類の抗体が存在し、現在、抗体医薬の主流となっているのは免疫グロブリンG(IgG)型の抗体である。ヒトのIgGには4つのサブクラス(IgG1、IgG2、IgG3、IgG4)があるが、従来、抗体医薬の精製に用いられてきたプロテインAはIgG3を除く3つのサブクラスに親和性をもつ。これに対し、プロテインGは4つのサブクラスすべてに対し親和性をもつ。
この特性だけをみればプロテインGのほうが精製のためのアフィニティーリガンドとして優れているように思えるが、親和性の強さやpH応答性に関してはプロテインAに及ばない。この点が、プロテインGが実験室では多用されるにもかかわらず、製造目的には好まれない理由であった。そこで、4つのサブクラスすべてに対応可能なプロテインGの、本来の性質を損ねることなく、抗体親和性などアフィニティーリガンドとして要求される分子特性をプロテインAより優れたものにすることを目標に、分子デザインを行った。
改変タンパク質の開発は2つの段階に分けて進めた。まず、プロテインGの分子構造を安定化できるようにタンパク質を構成するアミノ酸の配列を設計した(第一世代)。次いで、良好な安定性が得られた改変プロテインGに対して、親和性の向上など分子認識機能の改善ができるようにアミノ酸配列を再設計した(第二世代)。
第一世代の設計では、改変していない天然由来のプロテインGの、立体構造の座標データを独自に開発した分子デザインプログラムに入力してアミノ酸配列を設計した。その設計に基づいて複数の改変プロテインGを合成したところ、それらすべての改変プロテインGは、耐熱性が7~13℃、変性剤に対する耐薬品性が1.4~1.6倍、タンパク質分解酵素に対する耐性が4~14倍向上していた。タンパク質分子の安定化は精製工程におけるアフィニティーリガンドとしての耐久性向上につながることから、抗体医薬製造の低コスト化を進める上で重要な開発ポイントになる。次いで、この中から1つの改変タンパク質の立体構造をX線結晶解析により決定したところ、改変部分以外の原子座標(分子の立体構造)は改変前のプロテインGとほとんど変わっていなかった(図)。
第二世代の設計では、決定した第一世代の改変プロテインGの立体構造と、抗体であるIgG1の立体構造から、両者の複合体のモデル構造をまず推定し、このモデルについて複合体内での改変プロテインGとIgG1の接触界面における、静電的な反発力のシミュレーションなどによって、親和性が改善するようにアミノ酸配列を再設計した。再設計した改変プロテインGを合成しその性質を調べた結果、中性での抗体親和性が11倍、pH応答性(中性から酸性に変化した際の親和性の比で評価)が18倍向上していた。
認可済みの抗体医薬を対象に、この第二世代の改変プロテインGをアフィニティーリガンドに用いてアフィニティークロマトグラフィーの挙動を調べたところ、吸着した抗体医薬が溶出するピークのpH値が3.1から4.1へと弱酸性側にシフトできることが明らかになった。より穏やかな条件で精製処理できることは製造工程において抗体医薬が劣化してしまうリスクを低減できるため、抗体医薬の品質を保証する上で不可欠の要件である。なお、この第二世代の改変プロテインGはヒトIgGの4つのサブクラスすべてに対して十分な親和性を維持していた。
表は、プロテインA、無改変プロテインG、今回開発した、第二世代の改変プロテインGの分子特性をまとめたものである。すべての項目で改変プロテインGは無改変のプロテインGより優れており、今回の分子デザインが十分な効果を挙げたことが分かる。また、プロテインAと比べてもいくつかの特性は上回っており、すべてのIgGのサブクラスに対応することも含めて判断すると、抗体医薬製造の精製工程で現在主流であるプロテインAを代替することも可能であると考えている。
今回開発した改変プロテインGについては、抗体医薬製造の精製工程での活用を目指し、引き続き実用化研究を行うとともに企業への技術移転を進める。また、構築した分子デザイン技術に関しても、創薬および医薬製造管理分野での展開を図っていく。