-
シリカモノリスの利用等により、クロマトグラフィーと同等のタンパク質相互作用が検出可能
-
紫外吸光を用いるため、タンパク質を標識せずに測定可能
-
タンパク質アレイを用いて、多種類のタンパク質相互作用を同時に検出可能
-
これまでに開発した要素技術と合わせ、新機能抗体創製技術開発プロジェクトの最終目標である抗体精製システムを構成する要素技術一式の試作が完了
なお、本成果はBio Japan 2009(2009年10月7日(水)~9日(金)、パシフィコ横浜)NEDOブースにて展示致します。この他にもNEDOプロジェクトの成果を多数展示致します。ぜひご来場下さいますよう、ご案内致します。
NEDO、島津製作所、産業技術総合研究所、京都モノテック、バイオインダストリー協会は、医薬品用の抗体など、さまざまな抗体の特性に応じた最適な精製用リガンドを迅速に判定する「タンパク質アレイ解析システム」を共同開発しました。
従来の類似システムと比較し、大量のタンパク質をチップ上に配向固定できるため、クロマトグラフィーを用いた測定と同様の条件で、多種類のタンパク質相互作用の非標識同時検出が可能であり、実用的なスクリーニング等に利用できます。
本成果は、NEDO「新機能抗体創製技術開発プロジェクト」の一環であり、開発したシステムを活用し、抗体医薬品を安全かつ安価に提供可能とするため、精製プロセスの高度化技術の確立を目指し、プロジェクトを進めております。
高品質な抗体医薬品を低コストで製造するには、アフィニティ精製などの精製プロセスの高度化が欠かせません。このためには、多種・多様な抗体の精製に適合する、優れた精製用カラムの開発が課題となっております。
NEDO「新機能抗体創製技術開発プロジェクト」では、本課題の解決に必要となる3つの要素技術の開発を行っております。①103種類程度のアフィニティ・リガンドから成るライブラリーを一度に設計・構築し、これらの中から、②精製したい抗体に最も適したアフィニティ・リガンドをスクリーニングし、それをさらに最適化するという2段階の方法により、高性能の最適アフィニティ・リガンド創出、さらに、③リガンドを固定化する担体を開発し、これら技術を組み合わせ一連のシステムとして確立することを目指しております。
これまでに①及び③に対する要素技術を開発済み※であり、今回、開発に成功したアレイ解析システムは②に用いる要素技術です。②では、通常では抗体ごとに性質が異なることから、最適なリガンドをライブラリーの中から選別するため、約103種類の総当たり実験を行う必要がありますが、このスクリーニングに膨大な時間がかかるという課題がありました。そこで今回、高性能なアフィニティ・リガンドを迅速にスクリーニングするためのシステムを開発しました。本技術を用いることで、本工程を自動化し、膨大なリガンドライブリラリーの中から最適なリガンドを迅速に選別することを可能とします。
これにより、プロジェクトの最終目標である抗体精製システムを構成する要素技術一式の試作が完了しました。今後は開発したシステムを活用し、安全かつ安価な抗体医薬品の提供を可能とする、精製プロセスの高度化技術の確立を目指してプロジェクトを進める予定です。
※クロマトグラフィー用の高性能アフィニティ担体(ビーズ)の開発(2007年9月10日産総研発表)及びアフィニティ担体(シリカモノリス)の開発(2009年1月21日NEDO発表)
2006年度より実施している「新機能抗体創製技術開発プロジェクト」において、製造コストの低減に貢献する高効率なアフィニティ・リガンドスクリーニングの実現に向けた1つの提案として、タンパク質アレイ解析システムを開発しました。このシステムでは、これまで開発を進めてきたモノリス担体を基板として用い、この基板に多種・多様なリガンドをスポットして、アレイを作製します。スポット済み基板を測定装置にセットし、各スポットにおける例えば抗体との相互作用を解析します。このシステムは、(1)モノリス担体基板、(2)スポッティングに必要となるスポッタ、(3)測定装置一式、(4)解析用ソフトウエア、の4技術から構成されます。
(1)モノリス担体基板
京都モノテックが開発を進めてきたシリカモノリスを平板状に加工しました。厚さは0.1mmが標準であり、シリカモノリス自体の光散乱と自己吸収による影響を少なくしています。またナノメートルサイズとマイクロメートルサイズの構造を作り込んであり、それらのサイズは最適化されています(図1)。
 |
|
図1 モノリス担体基板
|
(2)スポッティングに必要となるスポッタ
島津製作所は、前述した基板に試料を滴下するためのスポッタを開発しました(図2)。この装置は、各種リガンド溶液を試料として、数10nLオーダーで96か所に順次自動滴下します。試料が混ざらないように、試料ごとにノズルを洗浄するなどの工夫が施されています。基板となるモノリス担体は、いわばミクロなヘチマ状の構造をしているため、リガンド溶液は滴下場所から真下へ染み込みます。今回利用したアフィニティ・リガンドは、産総研が開発した技術によりモノリス担体と速やかに反応し、C末端が選択特異的に架橋するようになっています。またN末端側を固定する技術も開発済みです。これらの技術により、リガンドは拡散することなく、その場で奥行き方向へ円柱状に固定されます。
 |
|
図2 開発したスポッタ
|
(3)測定装置一式
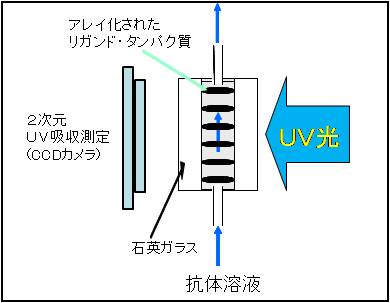
島津製作所が開発した測定装置(図4)に、準備した基板を石英ガラスに挟んで ホルダに装着(図3)しセットします。今回開発した測定装置は、光源と受光素子の間に基板を装着し、基板全体をCCDカメラで観察します。各スポット部分にはリガンド(タンパク質)があるので、これによりわずかに減光注1しますが、その他の部分では一定量の光が届くことになります(図5)。
セットしたフローセルに対し、例えば、抗体(タンパク質)溶液を通液するとスポットされているリガンドと相互作用し、結合した場合には、そのスポットのみでタンパク質の総量が増加するため減光量が大きくなり、その後の溶出工程で結合を強制的に外した場合には、タンパク質の総量が減少するため減光量が小さくなり、完全に外れた場合には、初期状態と同様の状態に戻ると期待されます。この原理により、96個のスポットに異なるリガンドを固定し1種類の抗体溶液を反応させた場合、この抗体がどのリガンドによく結合するか、あるいは外れやすい弱い結合をするのか、なかなか外れない強い結合をするのか、といったことをマルチに測定することが可能となります。
(注1)光源と測定素子の間に障害物がなければ100%の光を受光しますが、散乱・吸光する物質が途中にあるとその分だけ減光した光が受光素子に届くことになります。基板それ自体だけでも散乱・吸光が認められますが、そこにタンパク質が存在すると、タンパク質により光吸収が起こり、その分だけ減光した光が受光素子で測定されます。タンパク質は280nmの紫外光(UV)を選択的に吸光することから、この波長を用いて減光した光量を測定することにより、タンパク質の結合・解離を測定することができます。
 |
|
図3 ホルダに装着したモノリス担体
|
 |
|
図4 開発したアレイ解析システム
|
 |
|
図5 測定原理(厚み方向から見た側面図)
|
(4)解析用ソフトウェア
約8秒毎に画像を取り込むことで測定を行っています。そのままでは反応の状態を判断することが難しいため、画像処理により、各スポットを切り出し、おのおのにおける減光量を計測します。この数値をグラフ化するなどして、わかりやすい結果として表示することができます。
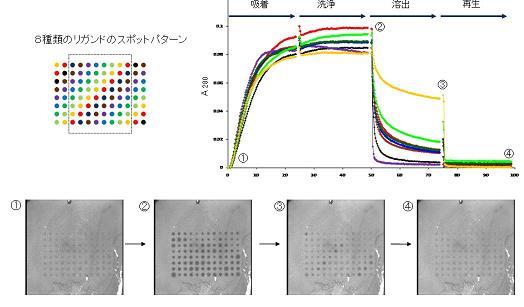
産総研は、開発全体の総括および装置の評価を行いました。評価結果の一例を図6に示します。この実験では全部で96個のスポットに8種類のリガンドを固定しています(図6の左上)。つまり複数ある同色の場所に同じものをスポットして、再現性の検証を兼ねています。これに、(A)抗体(この場合ヒトIgG)を含んだ中性緩衝液、(B)抗体を含まない中性緩衝液、(C)pH5の緩衝液、(D)pH2.5の緩衝液、の順に溶液を流し(図6グラフ横軸)、各スポットの280nmでの光シグナル変化を見ると(図6グラフ縦軸)、(A)では吸着が増加していき、(B)で吸着量がほとんど変わらず、(C)では吸着が減少し、(D)では吸着がさらに減少してほぼ最初の状態に戻ることがわかります。主な段階での、スポットの像を写真①~④に示します。(D)が終了すると、この担体はもう一度(A)のステップから再利用可能です。以上から、(A)は吸着、(B)は洗浄、(C)は溶出、(D)は再生、の各過程に対応していると考えられます。 (C)の工程で溶出の程度がリガンドにより大きく異なることは、優れたリガンドの探索が高いスループットで行える可能性を示しています。
 |
|
図6 実験結果の例(8種類のリガンド)
|
(1)タンパク質の標識の必要がない
(2)その場観察による視覚的検証ができる
(3)非特異吸着との差別化が容易(その場観察)
(4)クロマトグラフィー条件での特性評価が可能
(5)溶出特性のハイスループット解析に威力を発揮
(6)各種相互作用解析に利用可能
(7)アレイは、繰り返し利用(測定)が可能
(8)広範な用途が考えられる
類似システムとして、表面プラズモン共鳴(SPR)を用いるシステムがありますが、表面プラズモン共鳴は、溶液のpHや塩濃度などの溶液条件により大きく変化し、時にはシグナルがスケールオーバするため、実際のクロマトグラフィーなどで使用される測定条件を同時にカバーすることが困難です。そのためSPRは、基礎研究には有用なツールですが、実用化を目指した測定には不向きな点が多々ありました。本システムは研究室等において、クロマトグラフィーを用いて測定する方式をそのまま自動化したものであり、実用化を目指した測定に適しています。この新たな技術の導入により、治療用抗体開発の早い段階から、精製可能性(=製造コスト問題)などの検討を含めた総合的探索・開発・最適化が可能となります。
修正箇所
「2.研究成果」の「(3)測定装置一式 」の最初の段落の頭
「島津製作所が開発した測定装置(図3)に、準備した基板を石英ガラスに挟んでホルダに装着(図4)しセットします。」
↓
「島津製作所が開発した測定装置(図4)に、準備した基板を石英ガラスに挟んで ホルダに装着(図3)しセットします。」