独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)ダイヤモンド研究センター【研究センター長 藤森 直治】上塚 洋 研究員ならびにNianjun Yang 産総研特別研究員は、10nm間隔の微細な剣山構造をダイヤモンド表面上に形成し、これを電極材料とする電気化学センサーによって、DNAの高感度検出(2ピコモル/リットル:ピコは10-12)に成功した。この検出感度は、従来の電極材料を用いた電気化学センサーを数桁上回るものである。
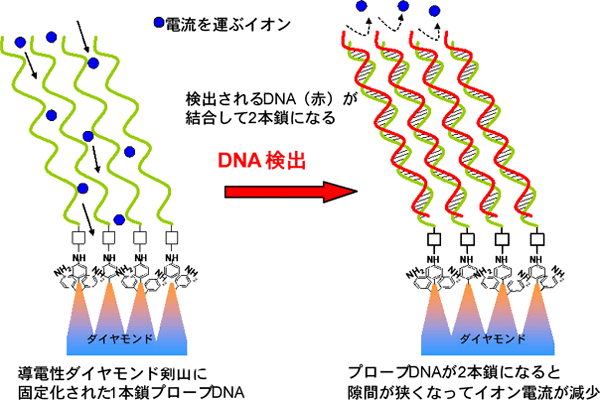
このセンサーは、導電性ダイヤモンドの表面に10nm間隔の微細な剣山構造を作製し、剣山の針の先にプローブDNA(1本鎖、長さ23塩基)を植え付けた構造を持っている。測定されるDNAはこのプローブDNA配列に特異的に結合して2本鎖となるので、ダイヤモンド表面の隙間が狭くなってイオン電流が減少する。この電流変化によって特定配列のDNAを検出する。金やカーボンを使った従来型のセンサーに比べると2ないし3桁高い感度を確認できた。
プローブDNAの配列を変えることによってさまざまなDNAの検出や、この方法をタンパク質に応用することにより、広範な疾病や微生物の検出・計測に適用可能でありインパクトの大きな技術である。
 |
|
導電性ダイヤモンド剣山に固定されたプローブDNAによるDNA高感度検出の原理図
|
DNA、腫瘍マーカーや抗体の検出などの疾病や食品の安全に関わるさまざまな生体物質への検出方法の高度化が求められている。DNAを計測する場合、血液などの検体からDNAを取り出して直接計測することで、迅速に高感度で判定出来るセンサーの開発が求められている。
また、生体内の状態を連続的に計測したり、食品検査などのラインを監視したりするようなセンサーでは、長期間安定したシグナルを得ることが必要である。これらの要求を満たすセンサーには、センサー材料自体の化学的な安定性と共に、その表面上に固定された計測対象に固有な生体物質の安定性が求められる。
ダイヤモンドは化学的な安定性が優れていると共に、電気化学的に非常に特異な性質を持っている。また、DNA等の生体物質を強く固定することができ、DNAチップへ適用された例もある。
ダイヤモンドを使ったバイオセンサーは、表面電気伝導層を使うタイプと、電気化学的な特性を利用するタイプに大別される。ダイヤモンドの電気化学的な特性は、電流を測定できる電圧範囲が広く、バックグランド電流が小さいことから、高感度センサーに応用出来ることが期待されてきた。
産総研ダイヤモンド研究センターでは、ダイヤモンド表面へのDNAの固定(結合)技術を研究し、光反応や電気化学反応によって、種々の固定化技術を確立してきた。また、その結合強度を測定し、他の物質への固定に比べてはるかに強固であることも発表してきた。
このダイヤモンド表面を加工する技術を用いて特定の塩基配列を有するDNAの検出を行うセンサーを開発してきた。
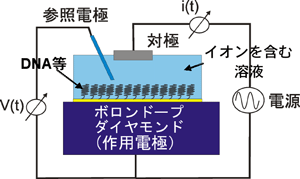
今回、高感度を実証した電気化学センサーの測定原理を図1に示す。ホウ素(ボロン)をドーピングした導電性ダイヤモンド(ボロンドープダイヤモンド)を作用電極(直径2mm)とし、イオンが存在する溶液中に対極を設置する。これらの電極間に電圧(-1V~1V)を加えることによって、ダイヤモンド電極へ到達するイオンの酸化還元反応で生じる電流を計測する。
 |
|
図1:ダイヤモンド電気化学センサーの模式図
|
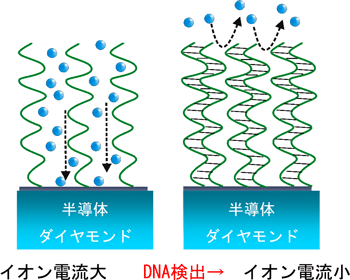
清浄表面の電極をこの測定系で計測すると、その材料固有の電気化学的性質(電圧-電位曲線)を得ることが出来る。表面にDNAを固定化すれば、露出する電極面積が減少し電流が小さくなる。図2に示すように、表面に1本鎖のプローブDNAのみが固定されている場合は、DNA同士の間隔が広くイオンは電極表面に到達しやすい状態になっている。ここにプローブDNAと相補的な配列のDNA(測定されるDNA)がやってくると2本鎖を形成(ハイブリダイズという)して、隙間が狭くなり、通過できるイオンの数が少なくなってイオン電流が小さくなる。すなわち、1本鎖と2本鎖の違いを電流量の大小として検出できる。ここで感度向上のためにはプローブDNAを最適な間隔で配列することが非常に重要な要素である。
 |
|
図2:電気化学センサーの動作原理
|
この電気化学センサーにおいてダイヤモンド表面の形状をナノメートルスケール(nm)で制御することにより、一層の特性向上を狙った素子を開発した。1本鎖DNAがハイブリダイズして2本鎖DNAを形成するために必要な間隔はおよそ10nm程度である。したがって、10nmの間隔に1本鎖のプローブDNAを設置することが出来れば、2本鎖DNAが形成された場合に、観測される電流を最も小さくすることができるので感度が最高になると考えられる。
 |
|
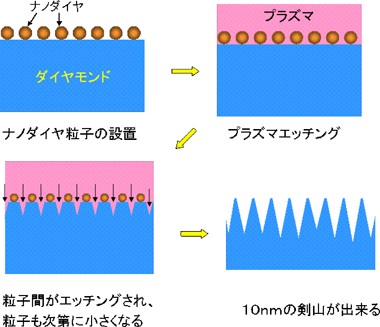
図3:ダイヤモンド表面へのナノ剣山の作製法
|
そこでダイヤモンド表面に10nmの間隔でDNAを並べるための微細加工技術を検討した。ダイヤモンドは酸素プラズマで容易にエッチング(酸化)加工できることが知られている。10nmの間隔にDNAを取り付ける場所を作ることは、半導体デバイス製造で用いられているような既存の微細加工技術で作製することは不可能である。そこで、直径10nmのナノダイヤモンド粒子をダイヤモンド表面にまぶしてマスク材料とした。この状態で酸素プラズマを用いてエッチングを行うと、10nm間隔の凸凹を持つ表面(ナノ剣山)ができる。図3にそのプロセスを模式的に示した。
できあがったダイヤモンド表面の凸凹は図4に示すAFM(原子間力顕微鏡)像及びその断面形状に示す通りである。AFMの解析からダイヤモンド表面に剣山構造が作製されていることが確認できる。
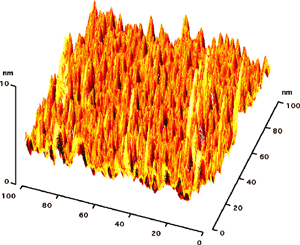
原子間力顕微鏡(AFM)像
|
|
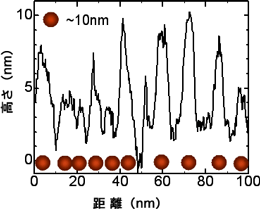
同左の断面形状
|
|
図4:10nmのナノ剣山構造
|
ダイヤモンドのナノ剣山にDNAを結合させるためには、リンカー分子と称する結合用の物質を置くことが必要である。剣山状のダイヤモンド表面に電気化学的な手法を用いて、リンカー分子であるニトロフェニールを取り付けた。この反応においては凸部の先端に電界が集中するので、ここに選択的にニトロフェニールリンカーを固定することができる。
取り付けたリンカーにDNAを取り付ける操作は、過去に当センターで開発した化学反応である。図5に取り付けたニトロフェニール及びプローブDNAの形態を模式的に示す。ここでは腫瘍マーカーのひとつとして知られるタンパク質の遺伝情報を有する23塩基からなる配列の1本鎖DNAをプローブDNAに用いた。試作した作用電極(直径2mm)を有するセンサーの外観を図6に示す。
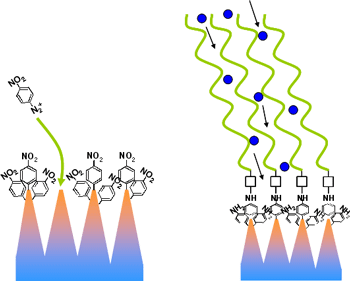
図5:先端へのニトロフェニール及びプローブDNAの固定
|
|

図6:センサーの外観
|
 |
|
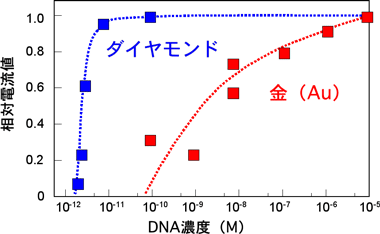
図7:ダイヤモンドDNAセンサーの特性
|
図7は、作製したセンサーの相対電流値(感度)を、溶液のDNA濃度を変えて測定したものである。図7から2pM(ピコモル/リットル:ピコは10-12)の濃度において計測が可能であることを示した。金(Au)などを使った従来型のセンサーに比べると2ないし3桁高い感度を確認できた。
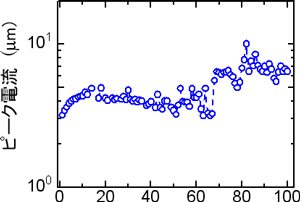
測定されるDNAは固定化したプローブDNAに結合して2本鎖になるが、温度を上げることによって2本鎖は分離するのでプローブDNAを1本鎖に戻すことができる。この操作を繰り返して長期的な安定性を調べたところ、図8のように100回の繰り返しにおいても安定した計測が出来ることを確認した。
 |
|
図8:100回の繰り返し計測
|
今後、さらに高感度のセンサーの開発を目指す。タンパク質である抗体や酵素の検出などで、高感度の検査が必要となることが考えられ、fM(フェムトモル/リットル:フェムトは10-15)の感度を目標としている。このためにはセンサー形状の小型化が重要な課題である。現在までに5µm(1µmマイクロメートルは10-6m)のセンサーの作製には成功しているが、さらに500nm(1nmナノメートルは10-9m)以下の形状を目指している。その形状では100fMの感度が期待できる。
医療検査への展開のためには妨害因子の影響をどれだけ減少できるかも課題である。現時点では特定の疾病や微生物などに関するDNAやタンパク質をターゲットにした研究は行っていないが、今後は個々の計測すべき生体物質に向けて最適なセンサーの開発も行う予定である。