独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)セルエンジニアリング研究部門【研究部門長 三宅 淳】細胞分子機能研究グループ【研究グループ長 三宅 淳(兼務)】中村 努 主任研究員と国立大学法人 大阪大学大学院工学研究科 井上 豪 教授らのグループは共同で、原始的な微生物において活性酸素を除去するタンパク質の反応を解析し、その新しいしくみを発見した。従来のメカニズムとは異なり、これまで天然物からは発見されていなかった超原子価化合物が重要な役割を果たしていることが確認された。
この発見は、タンパク質の酸化反応の新たなメカニズムであり、酸化ストレスに関する医療技術への応用が期待されるとともに、有機合成化学において新たな手法の開発にも寄与する。
本研究成果は、平成20年4月21日から25日(米国東部時間)の間に、米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America)電子版に掲載される予定。
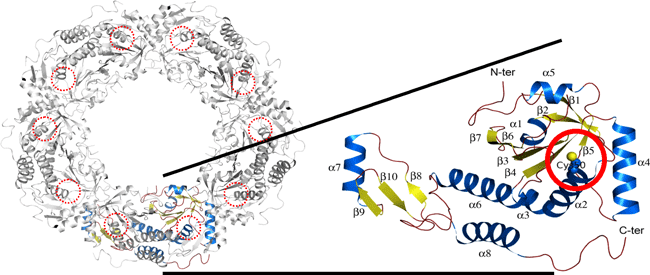 |
抗酸化タンパク質(エアロパイラム・ペルニクス(Aeropyrum pernix)由来ペルオキシレドキシン(Peroxiredoxin))の立体構造
赤丸は過酸化水素で酸化されるシステイン残基を示す。 |
酸素は呼吸などの生命活動に必須のものであるが、紫外線照射や酸素呼吸の副反応により、活性酸素という強力な酸化作用をもった物質にもなる。活性酸素による細胞へのダメージは酸化ストレスと呼ばれ、ガン、糖尿病、動脈硬化、アルツハイマー病などの疾患や老化にかかわるといわれている。酸化ストレスを防御するための医療技術の開発には、あらゆる医療技術がそうであるように、実際に生命がどのように防御しているかに学ぶことが重要である。生命は活性酸素による酸化ストレスから細胞を防御するために、さまざまな抗酸化タンパク質を備えるように進化してきた。これら抗酸化タンパク質がどのように進化してきたのか、どのようなメカニズムで活性酸素を除去するのかという問題は、医療技術の発展を考える上で本質的かつ重要なテーマである。
地球上に生命が誕生したとき、地球大気に酸素は蓄積していなかった。しかし大気に酸素が蓄積してくると、活性酸素による障害の除去が生存のための必須の条件となった。原始生命が活性酸素除去という生理機能を獲得したとき、その生理機能はどのようなメカニズムで作用していたのかという問題に取り組むためには、古細菌の抗酸化タンパク質はたいへん有効な研究材料である。なぜならば、古細菌と大きく分類される生物群は、遺伝子研究から、現存の生物では生命の起源に最も近いと考えられているからである。
産総研では、耐熱性タンパク質の産業利用を目指して、温度90℃以上で生育する超好熱性古細菌由来のタンパク質の研究を行ってきた。古細菌は一般に嫌気性のものが多いが、例外的に好気性のものがあり、活性酸素による酸化ストレスから自身を防御するシステムを持っていると期待される。好気性超好熱性古細菌 エアロパイラム・ペルニクス(Aeropyrum pernix)がそれで、産総研では地球上最古の抗酸化システムにせまるため、この古細菌内での抗酸化システムの解析を行ってきた。一方、大阪大学では薬剤開発を目的としたタンパク質の立体構造解析の研究を行ってきた。
両者は共同でこれらの研究をベースにして、この古細菌の抗酸化システムにおいて活性酸素の一種である過酸化水素を除去するタンパク質の立体構造を明らかにし、除去反応(タンパク質の酸化反応)にともなう立体構造の変化に着目した。
本研究は、文部科学省 タンパク3000プロジェクト 代謝系グループ「結晶化の研究」(平成17~18年度)および文部科学省 科学研究費補助金 特定領域研究「生体超分子の構造形成と機能制御の原子機構」(平成18~19年度)の支援を受けて行ったものである。結晶構造解析のためのX線源には、財団法人 高輝度光科学研究センターによる研究課題採択のもと、大型放射光施設SPring-8の放射光を利用した。
本研究では、タンパク質のX線結晶解析および量子化学計算の手法を用い、古細菌エアロパイラム・ペルニクス(Aeropyrum pernix)で過酸化水素(活性酸素の一種)を除去する抗酸化タンパク質 ペルオキシレドキシン(Peroxiredoxin)(以下「Prx」という、図1)の化学構造の変化を追跡した。Prxによる過酸化水素の除去は、Prx自身の一部であるシステイン残基(図1(c)の赤丸で示す)が過酸化水素で酸化されることによって進行する。
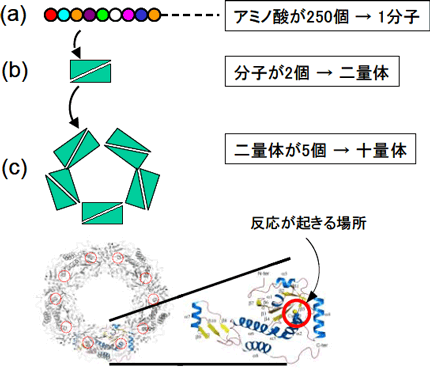 |
図1 抗酸化タンパク質(Aeroyrum pernix由来ペルオキシレドキシン)の立体構造
(a) 250個のアミノ酸で分子を構成 (b) 2分子が会合して二量体を構成 (c) 二量体5個が会合してリング状の十量体を構成 |
これまでの常識的メカニズムでは、タンパク質のシステイン残基の酸化はシステインスルフェン酸を中間体として起こると考えられていた(図2(a))。しかしPrxでは今まで考えられていなかったメカニズムで酸化反応が起こっており、システイン残基と近傍にあるヒスチジン残基により形成されるスルフラン誘導体を反応中間体とすることを発見した(図2(b))。これは酸化反応中間体のX線結晶解析により、スルフラン誘導体と合致する分子構造が観測されたことにより結論づけられたものである(図3)。
スルフランとは超原子価化合物の一種である。超原子価化合物は、反応化学・合成化学の分野でさまざまな用途に使われる有用な化合物である。これまでに確認された超原子価化合物はすべて化学合成によって得られたもので、天然物から見つかったことはなかった。この発見は、今まで人工物としてのみ認識され利用されてきた超原子価化合物が、実は生物によっても利用されていたことを初めて示すものである。
通常、化学反応の中間体は不安定で、X線結晶解析によってその姿が捉えられることは極めて稀である。本研究において反応中間体の構造を明らかにできたのは、特殊な方法を用いたことによる。その方法とは、タンパク質結晶を過酸化水素含有の母液に浸し引き上げた後、冷却窒素ガス(約 -190℃)で凍結し、SPring-8の放射光を用いてX線結晶解析を行ったというものである。溶液中の反応とは違い、結晶内の反応では、結晶を母液から除くことで容易に反応を停止できるため、過度の反応を防止することができる。さらに、反応停止後ただちに冷却することで不安定な反応中間体を固定することができ、不安定な反応中間体の構造を観測することができた。
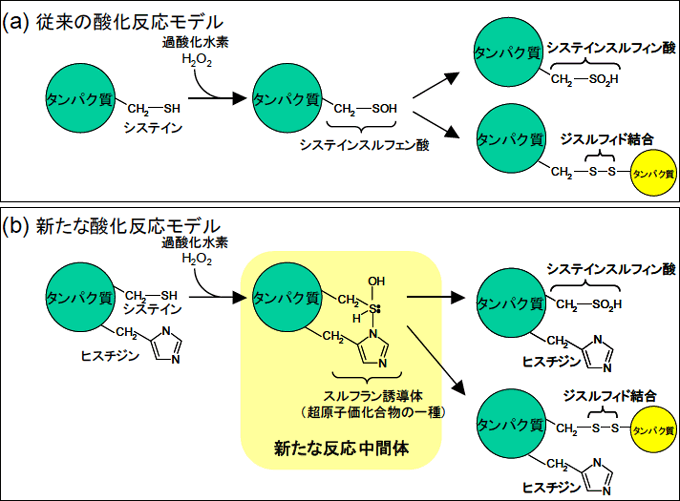 |
図2 タンパク質(システイン残基)の酸化のしくみ
(a)は従来の酸化反応モデルで、システイン残基はシステインスルフェン酸に酸化される。このとき硫黄原子Sは8個の原子価電子を有する。(b)は本研究により発見された新たなモデルで、システインは近傍のヒスチジン残基が関与する酸化反応により、中間体として硫黄原子Sは10個の原子価電子を有するスルフラン誘導体という化合物になる。(a) (b)いずれの反応中間体も、さらにシステインスルフィン酸に酸化されるか、ジスルフィド結合を形成する経路へと進む。ジスルフィド結合は同一のタンパク質分子内で形成されることもありうるが、ここでは異なるタンパク質との分子間ジスルフィド結合を図示した。 |
本発見は、抗酸化タンパク質による活性酸素除去の従来知られていなかった新しいメカニズムを明らかにしたものであり、酸化ストレスに対する医療技術を開発する上で大きな知見を加えるものである。タンパク質の酸化反応は活性酸素除去にとどまらず生物界において頻繁に見られる現象である。本発見はそのような一般的な現象についても新しいモデルを提唱している。
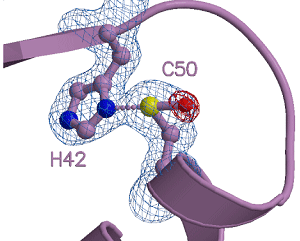 |
図3 新たな酸化反応中間体(スルフラン誘導体)の構造
X線結晶解析によって得られた酸化反応中間体の構造。システイン残基(C50)とヒスチジン残基(H42)が近傍に配置した結合(N-S結合)が見られる。球は原子を表し、それぞれの種類は以下の通りである。紫:炭素C、青:窒素N、黄:硫黄S、赤:酸素O |
また超原子価化合物の合成という面に着目すると、今回明らかになった反応経路(スルフラン類を中間体とする硫黄原子の酸化反応)は、硫黄原子を含む医薬品開発や有機工業化学の分野で新規合成法を開発するヒントとなり、有機化学の分野でも「原始生命に学ぶ」ことができるということを示したといえる。
本研究では、地球大気に酸素が蓄積し始めた初期の原始的な抗酸化システムの姿を知るために、好気性超好熱性古細菌由来のタンパク質の反応を解析した。その原始的な系で新たな活性酸素除去のしくみが発見されたことは興味深い。
本研究によって発見された新たな活性酸素除去のしくみは、酸化ストレスによるガン化や老化をターゲットとした医療技術への応用が期待できる。また、硫黄原子の酸化反応に新たな手法を与えることによって新規合成法の開発にも寄与すると考える。今後は、これらの医療・産業応用についてさらに研究を進めていく。