独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)セルエンジニアリング研究部門【部門長 三宅 淳】セルダイナミクス研究グループ 星野 英人 研究員は、近江谷 克裕 研究グループ長(現 北海道大学大学院医学研究科 教授)、中島 芳浩 主任研究員とともに、ルシフェリンールシフェラーゼ反応を利用して緑色蛍光タンパク質を効率よく発光させる技術とそれを利用した新しい生物発光イメージング技術を開発した。
これまで緑色蛍光タンパク質(GFP)の応用には蛍光を光らせるために外部光源を必要としていた。一方、ホタルなどの発光生物はルシフェラーゼという酵素の働きでルシフェリンという物質を酸化して、自ら発光する。今回、GFPとルシフェラーゼを結合させることによってルシフェリンさえあれば、外部光源なしでGFPを光らせる技術を開発した。GFPの種類を変えることによって発光色を変えることもできる。さらに本技術を応用して1細胞レベルでも観察が可能な新しい生物発光イメージング技術を開発した。
本研究の成果は、平成19年7月8日(アメリカ東部時間)に、米国の国際科学誌Nature Methods電子版に掲載される。
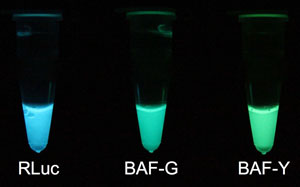
図1 ルシフェリン添加による試験管内での発光
左:RLuc 大腸菌で作製したウミシイタケルシフェラーゼ本来の青色発光
中:BAF-G 今回開発の自己励起蛍光タンパク質・BAF-Gによる緑色発光
右:BAF-Y 今回開発の自己励起蛍光タンパク質・BAF-Yによる黄緑色発光 |
|
 |
我々の日常生活において、『光技術』は必要不可欠な基盤技術であり、既に様々な発光システムが開発、利用されている。一方、我が国では、生物発光現象は『蛍の光』として古くから親しまれてきたが、最近、その発光メカニズムの解明が進行しつつある。生物発光は簡便な操作で高感度且つ高精度で迅速に計測できるユニークな天然のシステムであり、その基本原理の解明と新たなシステム開発が望まれている。
産総研では、生物発光の持つ可能性を探索し、生活に役立つ技術を目指した基礎技術として発展させてきた。セルダイナミクス研究グループでは、これまでに甲虫由来のルシフェラーゼを用いた3色ルシフェラーゼ技術の開発および実用化、並びにウミホタル由来の分泌性ルシフェラーゼ技術の開発および実用化を行っている。
一方、従来の緑色蛍光タンパク質(GFP)は外部励起光源を必要とし、測定にはこの励起光を除去して蛍光のみを選別する仕組みを必要とし、蛍光顕微鏡など複雑な計測システムでの利用に限られていた。我々は、オワンクラゲ、ウミシイタケといった海洋性発光生物のGFPを有する発光生物が本来備えている、ルシフェリンをエネルギー源としてGFPを光らせる、「生物発光共鳴エネルギー移動(BRET、 Bioluminescence Resonance Energy Transfer)」という現象に注目した。この現象を応用して簡便にGFPを光らせる技術とそれを用いた生物発光イメージング技術の開発を試みた。
本研究における“生物発光による1細胞イメージング技術の開発”は、独立行政法人 新エネルギー・産業技術総合開発機構(NEDO)細胞内ダイナミズム解析プロジェクトで推進したものである。
図2に示すように緑色蛍光タンパク質(GFP)と海洋性発光生物ウミシイタケのルシフェラーゼを適当なリンカーペプチドで結合した人工タンパク質を作製し、リンカーペプチド配列の最適化を行った。
その結果、非常に高効率のBRETを誘導することに成功した。我々は、これを自己励起蛍光タンパク質-BRET-based Auto-illuminated Fluorescent-protein(BAF)-という概念として提唱している。
 |
|
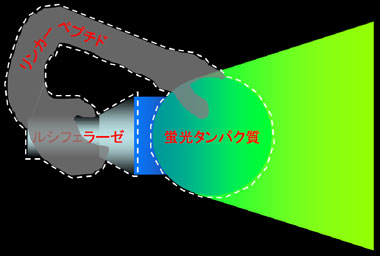
図2. 自己励起蛍光タンパク質(BAF)の概念図
BAFはルシフェラーゼと蛍光タンパク質をリンカーペプチドで連結した人工タンパク質(白点線)。ルシフェラーゼで蛍光タンパク質を照らして蛍光を誘導する。 |
3種のGFP変異体( AcGFP、E GFP、E YFP)を用いた人工タンパク質を作製しそれぞれBAF-A、BAF-G、BAF-Yと名付けた。これらは、ルシフェリンさえあれば蛍光を発する(図1)。用いるGFP変異体の特性により発光スペクトルが変化している(図3左)。図3右は、タンパク質量あたりこれら人工タンパク質の発光強度がルシフェラーゼ本来の強度に比べて約4倍に増強されていることを示している。これは共鳴エネルギー移動により、元のルシフェラーゼの発光量が増幅されたと考えられる。
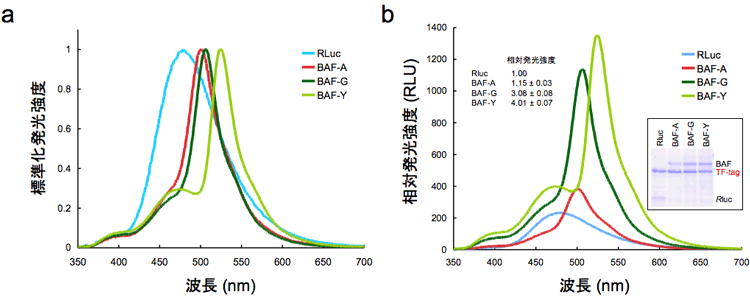 |
図3.元のルシフェラーゼ(RLuc)と今回開発の自己励起蛍光タンパク質(BAF)の発光スペクトル
(a)それぞれのスペクトルの極大値を1として標準化したスペクトル。元のルシフェラーゼのスペクトルが、それぞれのGFP変異体の特性を反映したスペクトルに変化する。
(b)タンパク質量を揃えた時の発光強度の比較。各タンパク質量を揃え、同一条件で発光量を測定した。発光量は各スペクトルが囲む面積として算出した。 |
培養細胞で発現させたBAF-Yは生きた細胞中でも高い効率で発光した。細胞核のDNAに集積するタンパク質(ヒストンH2AX)にBAF-Yを融合した人工タンパク質を発現させた細胞を、新しく開発した生物発光顕微鏡・AB3000B Cellgraph(ATTO)で観察した。図4に示すように高い空間および時間解像度での1細胞生物発光イメージングに世界で初めて成功した。
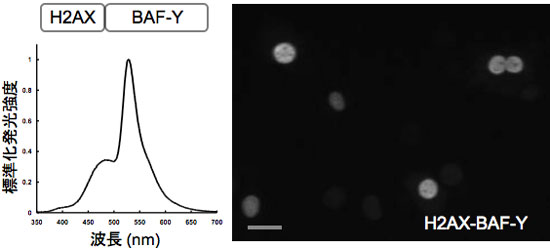 |
図4.BAF-Yを用いた1細胞レベルでの生物発光イメージング
細胞核のDNAに集積するタンパク質(ヒストンH2AX)とBAF-Yを融合した人工タンパク質H2AX-BAF-Yを細胞に導入した。
左:生きた細胞の中における生物発光のスペクトル
右:写真では6個の細胞核が個別に観察されている。核の中で黒く抜けている部分は核小体と考えられる。 |
我々は、本研究においてBAFがルシフェラーゼと緑色蛍光タンパク質との組合せにより、将来、より明るい生物発光プローブとして更に改善できる可能性を示した。今後、BAF自体の更なる改良と高効率BRETが起こる分子機構の解明を目指すとともに、細胞内で起こる現象を高精度且つリアルタイムにモニタ可能な生物発光イメージングシステムを目指す。また、簡便な検査試薬としての可能性も追求したい。