独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)計算科学研究部門【部門長 北浦 和夫】は、ガンなどの遺伝子治療薬として期待されているリボザイムの酵素反応を、量子力学に基づく第一原理・分子動力学計算法というコンピュータ・シミュレーション技術によって、詳細に解析することに初めて成功した。本技術は、新規のより効率的な遺伝子治療法の開発・設計などに貢献するものと期待される。
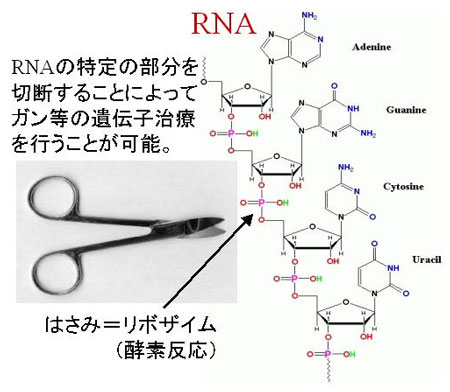
従来「酵素」は、その全てが「タンパク質」であると考えられていたが、20世紀後半に「リボ核酸(RNA)」にも酵素の働きをもつ分子が存在することが発見された。この酵素は「リボザイム」と呼ばれ、自分自身や他のRNAを切断する「はさみ」として作用することから、ガンなどの疾病の原因となっている遺伝子を切断するなど遺伝子治療への応用が強く期待されている。
リボザイムの酵素反応は触媒として金属イオンを必要とするが、その反応の仕組みは十分にわかっていない。そこで、化学反応を記述する量子力学(第一原理)と分子の熱振動を追跡する(分子動力学)計算手法を組み合わせた「第一原理・分子動力学計算法」を駆使して、リボザイムの酵素反応過程をコンピュータ内に再現した。これによって、実験では追跡することのできない反応の経路や詳細な仕組みを調べることに初めて成功した。
リボザイムの反応経路は複数あって非常に複雑であるが、生体内では望ましい反応のみが正しく選択される。これは、今回のシミュレーションによる解析の結果、リボザイムに結合している金属イオンが既にわかっている触媒の働きに加え、反応の経路をきちんと交通整理して正しい経路のみを選択・抽出する役割を果たしているためであることが初めて明らかとなった。
これらの計算結果は、従来の実験結果ともよく合致しており、本計算技術を用いることによって分子がどの反応経路を通るか(または通らないか)などについて予め知ることができるようになったことを意味する。従って、今後こうした計算技術をさらに発展させることにより、遺伝子治療分野におけるコンピュータを用いたより効率的な治療法(治療薬)の開発・設計に道を拓くものと期待される。
 |
|
イメージ図 |
リボザイムの反応については、これまでにも世界的に非常に多くの研究が行われてきた。日本においては、産総研・ジーンファンクション研究ラボの多比良ラボ長らの研究グループが、世界をリードする優れた研究を精力的に推進している。しかしながら反応過程の詳細は未だ不明であり、特にリボザイムに結合する金属イオンの役割については、その基本的な機能・役割についてさえ研究者によって異なる見解が述べられているのが実情である。
また、コンピュータ・シミュレーションを用いた反応機構に関する研究では、コンピュータによる計算量を節約し現実的な時間内で計算を終了させるために、実際のリボザイムよりもかなり簡単化したモデル物質がこれまで用いられてきた。さらに実際の生体内では、分子は常に熱によって振動しており、これが酵素反応のきっかけとなっているが、従来用いられてきた計算法(ハートレー・フォック法)では、分子の熱振動性はまったく取り入れられていなかった。
今回の研究では、こうした従来の計算法よりも効率的で、かつ分子の熱振動の様子までも導入した計算法をリボザイムに初めて適用した。これによって、リボザイムの様々な反応過程を詳しく追跡することに成功した。
なお本成果は、2002年03月まで新エネルギー・産業技術総合開発機構の産業技術研究員制度(NEDOフェローシップ)の研究員であったBoero Mauro(ボエロ マウロ)博士が、アトムテクノロジー研究体(JRCAT) において行った研究を基としており、これらの成果は2002.07.31発行のJournal of the American Chemical Society(米国化学学会誌)に掲載された。
リボザイムの反応は複雑であり、存在する環境・条件によって複数の反応経路が存在し、それらがお互いに競い合っている(反応の競合)ほどである。しかし、生体内では、それら複数の反応経路の中から望ましい反応のみが正しく選択されて起こる。
コンピュータ・シミュレーションによって再現したリボザイムの反応経路を詳しく解析したところ、金属イオンが存在しないときには、切断とは異なる反応が起こってしまうことを見出した。これに対して、リボザイムに金属イオンが結合しているときには、生体内と同じ正しい切断反応が再現された。
これはシミュレーションの結果が正しいことを示していると共に、リボザイムに結合している金属イオンが反応の過程で触媒として働くのみならず、競合する複数の反応経路の中から正しい経路を選択・抽出するための要となっていることをも示している。
上述の金属イオンの役割は、リボザイムの反応過程を逐一詳細に追跡することが可能になって、初めて明らかになったものである。実験で得ることが非常に困難な反応過程の詳細な様子についても、第一原理・分子動力学計算法を用いれば、動画像によって視覚化して解析することが可能となる。
今後は、本技術をより洗練させ、生体内の環境により近い条件下での反応の解析を実現し、さらに定量的かつ高精度なシミュレーションを達成する予定である。これらの技術開発がより発展すれば、現実の医療への応用を目指した遺伝子治療薬としてのリボザイムの開発・設計を、コンピュータ内において行うことも可能になるものと期待される。即ち、実際にリボザイムの反応実験を行わなくとも、コンピュータ内で目的に合った治療薬の反応実験を試みることができるようになると考えられる。
また、本技術の応用はリボザイムの反応に限定されたものではなく、より広範なタンパク質が行う酵素反応の解析にも適用可能な一般的な手法であり、酵素反応の過程を改変し目的にあった機能をもつタンパク質を自在に設計するための新しい技術開発へと道が拓かれるものと期待される。
一方で、このように実際的かつ実用的な計算技術の開発のためには、実験グループとの共同が重要であり、産総研・ジーンファンクション研究ラボとの密接な情報交換の下、生体機能分子の理論的な設計においても飛躍的な研究の進展を期したいと考えている。
また、こうした高精度かつ大規模な計算技術を現実問題に適用するためには、計算量の著しい増大にも対処しなければならない。そこで今後は、産総研・グリッド研究センターなどと連携し生体機能分子に関する大規模シミュレーションを実現すると共に、さらに、その解析結果・動画像などの大量データをグリッド・データベースシステムに蓄積し、広く世界の研究者に公開するなどグリッド技術を最大限に活用した計算環境の構築にも努力したいと考えている。