国立研究開発法人 産業技術総合研究所【理事長 石村 和彦】(以下「産総研」という) 細胞分子工学研究部門 動的創薬モダリティ研究グループ 竹内 恒 研究グループ長、徳永 裕二 研究員は、国立大学法人 東京大学【総長 五神 真】、中外製薬株式会社【代表取締役会長 小坂 達朗】と、抗体の高次構造(HOS)情報を、製剤条件・低温保存温度で、非破壊的に取得できる、独自のNMR測定技術を開発した。
バイオ医薬の躍進に伴い、その薬効や安全性をHOSに基づいて評価することが求められている。しかしながら、溶液組成や測定温度の制約を受けずに、抗体などの高分子量バイオ医薬のHOS情報を非破壊的に取得する技術は確立されていなかった。今回、新たに開発した窒素核観測CRINEPT法(N-CRINEPT法)には、産総研のNMR測定技術をさらに高度化し、高分子量条件でNMR信号の生成効率を最大化する全く新たな実験スキームを導入した。これにより、大幅な感度とHOS情報の網羅性の改善、完全な非破壊性を実現した。今回開発した技術により、抗体分子のHOS情報を、製剤保存条件で、ありのまま取得できるようになり、抗体医薬の研究開発への貢献が期待される。また、本手法を用いることでNMR法により解析可能なタンパク質の数を飛躍的に向上させることが可能である。
なお、この技術の詳細は、2020年05月06日(米国東部夏時間)にJournal of Medicinal Chemistryに掲載された(doi: 10.1021/acs.jmedchem.0c00231)。
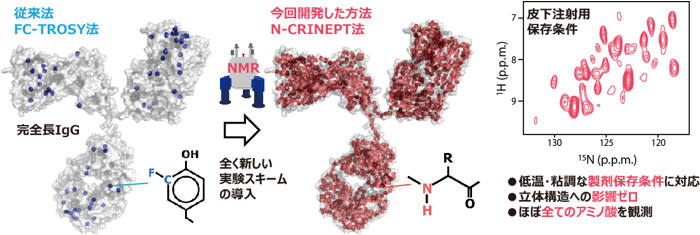
バイオ医薬のHOSを完全非破壊で観測できるN-CRINEPT法
抗体構造中の青丸と赤丸は、観測可能なアミノ酸の位置を示す。
近年、抗体に代表されるバイオ医薬のシェアが拡大している。バイオ医薬が薬効を発揮するには、主成分である抗体タンパク質などが、溶液中で適切な高次構造(HOS)をとる必要がある。一方、抗体タンパク質のHOSは、熱などにより劣化しやすい。抗体タンパク質の劣化は、抗体医薬の薬効を減弱させるだけでなく、副作用を増強させるため、そのHOS情報の取得は、安全性を担保する上でも極めて重要である(図1)。しかしながら、これまでの分析技術では測定自体がHOSに影響を与える恐れがあり、また溶液条件でタンパク質のHOS情報を非破壊で得られるNMR法を用いても、製剤条件のまま低温保存温度で完全に非破壊的なHOS解析は行えなかった。
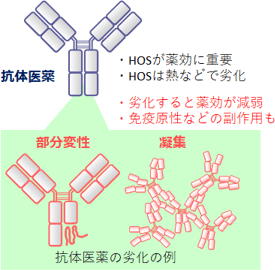
図1 抗体医薬の劣化とHOS解析の重要性
産総研では、NMR法の利点を生かし、製剤条件のまま低温保存温度で、完全に非破壊で網羅的なHOS解析を行う技術開発を目指し研究を進めてきた。その一環で、2019年に開発したFC-TROSY法により、分子量15万以上の抗体について、実用に足る非破壊観測が、初めて可能になった(産総研プレス発表2019年3月12日)。しかし、観測できる箇所が芳香族アミノ酸に限られていたこと、また、フッ素核導入によるタンパク質のHOSの変化は一般的に無視できると考えられているものの、HOSを変化させる可能性はゼロではないことなどから、完全な非破壊性は達成できていなかった(図2左)。そこで、今回、完全に非破壊でHOSを観測できる技術の開発に取り組んだ。
なお、今回の開発は、国立研究開発法人 日本医療研究開発機構の委託事業「次世代治療・診断実現のための創薬基盤技術開発事業」、独立行政法人 日本学術振興会の助成事業 挑戦的研究(萌芽)(課題番号:18K19415、2018~2019年度)と基盤研究(C)(課題番号:19K07040、2019~2021年度)による支援を受けて行った。
今回開発したN-CRINEPT法(正式名称は15N-detected cross-correlated relaxation and insensitive nuclei enhanced by polarization transfer、窒素15直接観測と交差緩和による低感度核の感度増強法)は、NMRによる観測を可能にするため、自然界では0.1 %含まれる安定同位体の窒素15の割合を高める安定同位体標識をアミド部分に施す必要があるが、FC-TROSY法で必要だったフッ素導入のような異なる元素の導入は不要でHOSを変化させる恐れがなく、完全な非破壊性を実現した。また、実験開始から測定までの時間を最小にし、高分子量条件でアミドのNMR信号の生成効率を最大化する全く新たなNMR実験スキームを開発、導入したことで、芳香族アミノ酸に限らず、プロリンを除くすべてのアミノ酸残基に由来する信号が取得できる(図2右)。これにより、得られるHOS情報の網羅性が大幅に改善された。
N-CRINEPT法を、医薬品として使用されている抗体と99 %以上のアミノ酸配列相同性を持つ抗体分子に適用したところ、複数の製剤組成で保存温度でのNMR信号が観測できた(図3)。さらに、N-CRINEPT法により、製剤条件の違いによるHOSの変化の検出や、糖鎖修飾が不均一な試料の各糖鎖修飾の存在割合の定量も可能であった(詳細は論文を参照)。これらのことから今回開発したN-CRINEPT法は、その有効性が証明されれば、すでに安定同位体標識が汎用(はんよう)されている開発段階だけでなく、バイオ医薬の生産・製剤化・輸送・保存など多様な局面での活用も期待される(図4)。これまで分子量15万を超えるようなタンパク質のNMR解析を行うには、タンパク質の水素原子を重水素原子に置き換える重水素化が必要であった。しかし、新型コロナウイルス(SARS-CoV-2)の表面タンパク質など、大きな膜タンパク質の多くは哺乳細胞などでしか発現できず重水素化が難しいため従来のNMR技術では解析できなかった。N-CRINEPT法は、それらの大きな膜タンパク質のHOS解析などにも利用できるため、幅広い応用が可能である。
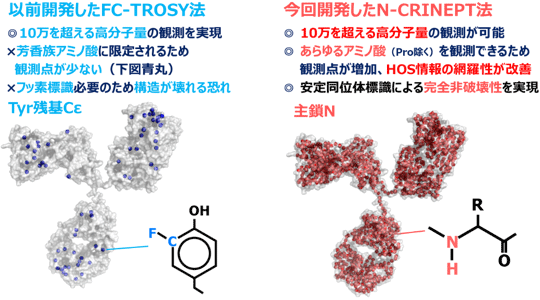
図2 完全非破壊観測が可能なN-CRINEPT法
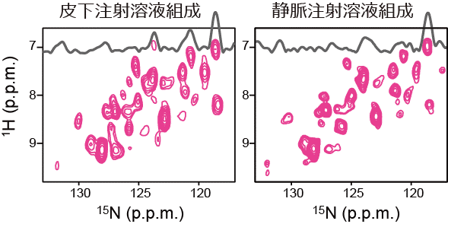
図3 各種製剤組成における抗体のN-CRINEPTスペクトル
1つのシグナルが1つのアミノ酸残基に対応している。31個のシグナルの出現が期待されるが、2つの処方条件ともに70 %以上のシグナルが観測された。両者のパターンが類似していることは、高次構造がほぼ同一であることを示している。
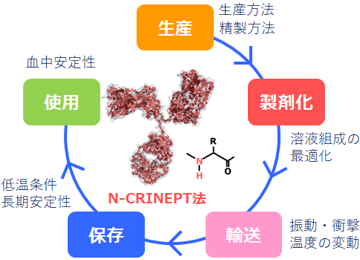
図4 N-CRINEPT法の使用が想定されるさまざまな局面
今後はN-CRINEPT法を、研究・開発段階の抗体医薬に適用するなど、社会実装を進める。また、NMR法を用いた創薬支援基盤技術をさらに発展させ、バイオ医薬に限らず、低分子、中分子など多様な医薬に対応できる創薬基盤技術プラットホームを構築していく。
国立研究開発法人 産業技術総合研究所
細胞分子工学研究部門 動的創薬モダリティ研究グループ
研究員 徳永 裕二 E-mail:tokunaga.y*aist.go.jp(*を@に変更して送信下さい。)
細胞分子工学研究部門 動的創薬モダリティ研究グループ
研究グループ長 竹内 恒 E-mail:koh-takeuchi*aist.go.jp(*を@に変更して送信下さい。)