独立行政法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)幹細胞工学研究センター【研究センター長 浅島 誠】糖鎖レクチン工学研究チーム 舘野 浩章 主任研究員、平林 淳 首席研究員 兼 研究チーム長、器官発生研究チーム 小沼 泰子 主任研究員、伊藤 弓弦 研究チーム長は、和光純薬工業株式会社【代表取締役社長 小畠 伸三】(以下「和光純薬工業」という)試薬事業部 試薬開発本部 ライフサイエンス研究所と共同で、移植用細胞に残存する未分化のヒトiPS細胞やヒトES細胞(以下「ヒトiPS/ES細胞」という)を、通常は廃棄する細胞培養液を用いて簡便に検出する技術を開発した。
ヒトiPS/ES細胞から分化させて作製した移植用細胞には、未分化のヒトiPS/ES細胞が残存する場合があり、この未分化ヒトiPS/ES細胞が腫瘍化する危険性があることが、ヒトiPS/ES細胞を医療に応用する際の最大の障壁となっている。今回開発した技術により、貴重な移植用細胞の一部を無駄にすることなく調べることで、ヒトiPS/ES細胞の安全性を事前に把握することができる。ヒトiPS/ES細胞を用いた再生医療の安全性向上への貢献が期待される。なお、この技術の詳細は、「Scientific Reports」(Sci. Rep. 4, 4069)にオンライン掲載された。
 |
|
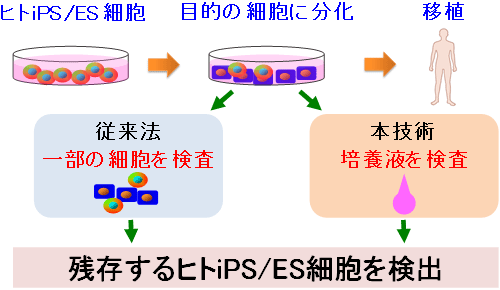
図1 移植用細胞に残存するヒトiPS/ES細胞を培養液で検出 |
ヒトiPS/ES細胞は、いろいろな細胞に分化できる能力(多能性)と分裂して自分と同じ性質の細胞を増やせる能力(自己複製能)をもつことから、再生医療のための細胞材料として大きな期待がよせられている。一方、ヒトiPS/ES細胞を用いた再生医療で解決すべき最大の課題は、ヒトiPS/ES細胞から分化させることにより調製した移植用の細胞に、ヒトiPS/ES細胞が残存していると、それらが腫瘍を形成する危険性があることである。患者の危険性を最小限にするためには、実際に移植治療を行う前に、移植用細胞にヒトiPS/ES細胞がどの程度残存しているかを品質検査する必要がある。そのため、移植用細胞に残存するヒトiPS/ES細胞数を計測する技術の開発が求められていた。
しかしながら、フローサイトメトリー法やqRT-PCR法などの従来技術では、せっかく作った移植用細胞の一部を破壊して検査に使用する必要があった。このような問題点を解決するために、細胞自体を用いずに、移植用細胞にわずかに混入するヒトiPS/ES細胞を簡便に検出する新たな技術の開発が求められていた。
産総研は、再生医療の促進と普及に向けて、世界標準となるヒト幹細胞の品質評価・選別技術の開発を目指しており、レクチンマイクロアレイによって、細胞表面を高濃度に覆う糖鎖を標的とした幹細胞マーカー(指標)の開発に取り組んできた。
この一環として、和光純薬工業との共同研究により、レクチンの一種であるrBC2LCNが、ヒトiPS/ES細胞に特異的に結合すること、rBC2LCNがヒトiPS/ES細胞を生きたまま染色できることを見いだした。また、rBC2LCNがヒトiPS/ES細胞のポドカリキシンという糖タンパク質上の特定のO型糖鎖に結合することを明らかにした(2013年3月19日 産総研プレス発表)。
なお、本研究開発は、和光純薬工業からの資金提供型共同研究(平成23年度~)により産総研と和光純薬工業が共同で実施した。
今回、ヒトiPS/ES細胞に特徴的なO型糖鎖をもつポドカリキシン(H3+ポドカリキシン)が、さまざまな種類のヒトiPS/ES細胞から培養液中に分泌されていることを見いだした。一方、ポドカリキシンは腎臓など他の組織にも存在するが、ヒトiPS/ES細胞に特徴的なH3+ポドカリキシンは調べた限り通常の体細胞からは分泌されていない。すなわち、培養液中のH3+ポドカリキシンを調べることで、細胞自体を使わずにヒトiPS/ES細胞を検出できる。
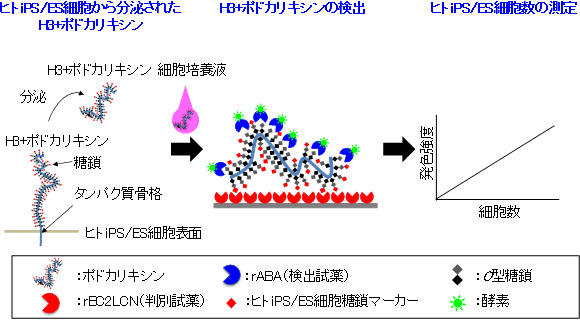
通常、タンパク質は特有のアミノ酸配列を認識する抗体を用いて検出することが多いが、ポドカリキシンは多量のO型糖鎖で覆われた巨大なムチン様タンパク質であるために、抗体を用いることはできなかった。そこで、H3+ポドカリキシンに多く存在する特徴的な糖鎖構造に着目し、そのO型糖鎖を認識するレクチンを2種類用いて検出する新しいサンドイッチアッセイ系による検出システムを考案した(図2)。詳細な方法は以下の通りである。
① H3+ポドカリキシンを認識するrBC2LCNを判別試薬として固定化した反応容器を準備する。
② 1滴(50 µL)の細胞培養液を反応容器に入れ1時間反応させてH3+ポドカリキシンを吸着させる。
③ 洗浄して細胞培養液を除いた後、rBC2LCN とは別の
O型糖鎖を認識する
酵素標識rABAを、反応容器に吸着したH3+ポドカリキシンと1時間反応させる。
④ 酵素標識rABAを発色させ、その発色強度を測定して、H3+ポドカリキシン量を決定する。
⑤ H3+ポドカリキシン量から、H3+ポドカリキシンを分泌したヒトiPS/ES細胞数を算出する。
今回開発した検出システムのポイントは、第一にrBC2LCNを判別試薬として用いてヒトiPS/ES細胞から分泌されるH3+ポドカリキシンだけを選択的に反応容器に吸着させること、そして、第二に1分子のH3+ポドカリキシン上に100個以上あると予測される構造のO型糖鎖を認識するrABAを検出試薬とすることで、1分子のH3+ポドカリキシンに多くの酵素を付着させることにより高感度検出を実現したことである。すなわち2種類のレクチンを用いることで、選択性と高感度を両立させている。
今回開発した検出システムを用いると、多数の検体を迅速(3時間以下)に検査できる。また、10 mLの培養液で1000万個の細胞を培養している場合、5000個(0.05%)以上のヒトiPS/ES細胞が検出できる。移植用細胞中のヒトiPS/ES細胞の混入率を測定できるため、ヒトiPS/ES細胞を用いた再生医療の安全性評価法として期待できる。
 |
|
図2 今回開発したヒトiPS/ES細胞の検出システムの原理図 |
本技術を実際の再生医療に用いるヒトiPS/ES細胞由来の移植用細胞の安全性評価に利用し、ヒトiPS/ES細胞を用いた再生医療の促進に貢献する。また本技術の感度と定量性を向上させるとともに臨床検査機器を開発し、再生医療分野に広く普及させていく予定である。
独立行政法人 産業技術総合研究所
幹細胞工学研究センター 糖鎖レクチン工学研究チーム
主任研究員 舘野 浩章 E-mail:h-tateno*aist.go.jp(*を@に変更して送信下さい。)
首席研究員 兼 研究チーム長 平林 淳 E-mail:jun-hirabayashi*aist.go.jp(*を@に変更して送信下さい。)