北里大学海洋生命科学部の安元剛講師、窪田梓氏(現 日本電子)、大野良和研究員、琉球大学農学部の安元純助教(総合地球環境学研究所・共同研究員)、産業技術総合研究所地圏資源環境研究部門の飯島真理子研究員、東京大学大学院農学生命科学研究科の鈴木道生教授、トロピカルテクノプラスの廣瀬美奈博士の研究グループは、総合地球環境学研究所LINKAGEプロジェクト(※1)の一環で、ミドリイシサンゴの幼生の骨格形成時のpH(※2)を、共焦点レーザー顕微鏡によるpHイメージング(※3)という手法で調べました。その結果、サンゴ幼生が海水を骨格形成部位に取り込み、その部位にポリアミン(※4)という生体アミンを輸送してpHを上昇させ、炭酸カルシウム(CaCO3)の骨格を形成する新しい石灰化モデルを提案しました。従来の石灰化モデルでは、サンゴの石灰化(※5)が二酸化炭素(CO2)を放出する可能性が指摘されていましたが、本研究では、サンゴがむしろCO2をCaCO3として効率的に固定していることを明らかにしました。この発見は、サンゴ礁が地球規模のCO2固定において果たす役割を再評価する重要な一歩となります。本研究成果は、アメリカ化学会(ACS)が刊行する “Environmental Science & Technology” 誌に、2024年12月10日(日本時間)に掲載されます。
造礁サンゴは、石灰化と呼ばれるプロセスを通じて骨格を形成し、その骨格がサンゴ礁を構成します。この石灰化プロセスは、大気中や海水中のCO2が海水中のカルシウムイオン(Ca2+)と反応し炭酸カルシウム(CaCO3)として固定されるという一見するとCO2固定反応です。しかし、従来は、海水中のpHが8 程度であることから、海水中に溶けている炭酸水素イオン(HCO3-)を原料とすると仮定され、式1のような石灰化反応で説明されてきました。
Ca2+ + 2HCO3- → CaCO3 + CO2 + H2O (式1)
そのため、石灰化過程が海水中へのCO2放出を伴うと考えられ、サンゴの骨格形成が地球温暖化を加速する可能性が議論されてきました。しかし、現在の地表の炭素のうち、約半分は石灰岩などの炭酸塩堆積物として膨大な量のCO2が閉じ込められており、地球のCO2固定に大きく寄与しているとの考えもありました。このように、サンゴ礁が地球規模の炭素循環において果たす正確な役割については、不確定な部分が残されていました。生き物がCaCO3などの鉱物を作る作用をバイオミネラリゼーションと言い、近年の機器分析技術の発展により、バイオミネラリゼーションの解明が進んでいます。
研究グループは、共焦点レーザー顕微鏡を用いて、コユビミドリイシ(造礁サンゴの一種)のサンゴ幼生の骨格形成部位である細胞外石灰化液(Extracellular Calcifying Medium: ECM)を様々な方法で観察しました。カルシウムイオン(Ca2+)を可視化するカルセインという蛍光試薬を用いて海水からECMへのCa輸送経路を調べたところ、サンゴ幼生は細胞間の隙間からCaをECMに取り込んでいることが明らかになりました【図1】。これまで細胞内からカルシウムを輸送するサンゴも知られていましたが、この種のサンゴは細胞間の隙間が大きく海水が容易にECMに入り込むことがわかりました。
また、ECMの微細なpH変化をpHイメージングという手法で可視化しました。その結果、サンゴ幼生は骨格形成時にECMのpHを0.5~1程度上昇させていることがわかりました【図2a】。このpH上昇の機構としてはCa2+輸送体の寄与が推定されていました。本研究ではCO2を保持する生体塩基のポリアミンの寄与を推定し、ポリアミンの輸送体阻害剤と生合成阻害剤をサンゴ幼生の飼育海水に添加してECMのpH上昇への影響を調べました。その結果、ポリアミン輸送体阻害剤を添加した際に、ECMのpH上昇が有意に低下しました。つまり、サンゴは、ポリアミンという生体塩基を用いてECMのpHを上昇させていることを発見しました。このpHの上昇により、炭酸イオン(CO32-)の供給が促進され、CaCO3がCO2放出を伴うことなく効率的に形成されることが明らかになりました。細胞内のポリアミン量も蛍光プローブを用いて可視化することに成功しました。ポリアミン量が多い細胞がECMの周囲に集まっている様子が観察できました【図2b】。
上記の結果をもとに、サンゴ組織の模式図とECMにおける骨格形成反応の新仮説を提案しました。サンゴの炭酸カルシウム骨格は細胞外のECMで作られ、材料となるカルシウムは細胞の隙間を通って海水からも供給されます。サンゴのECMでの石灰化プロセスにおいて、アルカリ化は無機炭素がポリアミンと共にポリアミン輸送体を介して移動することで、pHが上昇し、石灰化を促進すると考えられます【図3】。
海洋生物が炭酸カルシウム(CaCO3)を生成する過程でCO2を放出するという(式1)はCO2が飽和した溶液中でのCaCO3再沈殿を表すものであり、海洋生物の石灰化がこの反応に完全に従うという十分な証拠はありません。無機化学的には、石灰化は主にCa2+とCO32-の反応によって進行し、高いpH環境が必要です。一方、CaCO3の溶解は低いpHで起こります。したがって、pHが継続的に低下すると、CaCO3の沈殿は起こりません。従来の「石灰化中のpH低下」という主張に反して、最近の研究ではpHの上昇がサンゴ以外の生物でも観察されています。CaCO3結晶は、炭酸(H2CO3)とカルシウムを含む塩基(例えば水酸化カルシウム(Ca(OH)2))の中和反応によって生成される塩であり、CaCO3の形成は塩基に依存しています。炭酸水素イオン(HCO3-)由来の水素イオン(プロトン)は塩基やCa(OH)2によって中和されるため、すべてのプロトンが周囲の海水に放出されるわけではありません。近年、海にアルカリ薬剤を添加してCO2固定を促進する海洋アルカリ化という試みも海外では実施されてきています。サンゴなどの石灰化生物がCO2を放出するか固定するかを議論するには、生態系全体の観点で評価する必要があります。CO2は光合成によって有機物に変換され、石灰化生物はこの有機物をエネルギー源としてCaCO3骨格を作ります。このプロセス全体を考えると、CO2は実質的にCaCO3に変換されており、CO2は固定されていると言えます。
海水中に存在するCaCO3の滞留時間は3億年と言われ、ほとんど溶解しないことが知られていますが、海洋環境でのCO2吸収への寄与は、海草などの光合成による有機物生産(ブルーカーボン)が主に注目されています。本研究では高pH条件下での石灰化が必ずしもCO2の放出を引き起こさずCO2固定となることを示しました。今後は、貝など様々な海洋生物の石灰化機構を詳細に検証すると共に、サンゴ礁海域での石灰化によるCO2固定量を再検証し、サンゴ礁が地球のCO2隔離に貢献することを証明していきたいと考えています。将来的には石灰化生物による新しいブルーカーボン(Biogenic Calcifying Blue Carbon)を提唱し、サンゴ礁保全に貢献できる仕組み作りに取り組んでいきたいと考えています。
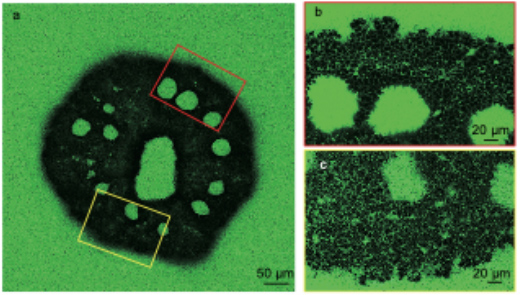
図1 サンゴの幼生におけるECM(細胞外石灰化液)内の細胞間隙の可視化(カルセイン染色を用いた共焦点レーザー顕微鏡(CLSM)観察):(a) サンゴ幼生全体の様子を示した画像(スケールバー:50 μm)。(b) (a)の赤い四角で示された領域を拡大した画像(スケールバー:20 μm)。(c) (a)の黄色い四角で示された領域を拡大した画像(スケールバー:20 μm)。(b)と(c)の両方で、ECM内における細胞間隙が視覚的に確認されていることが示されている。つまりサンゴのECMには海水が容易に入り込むことがわかる。
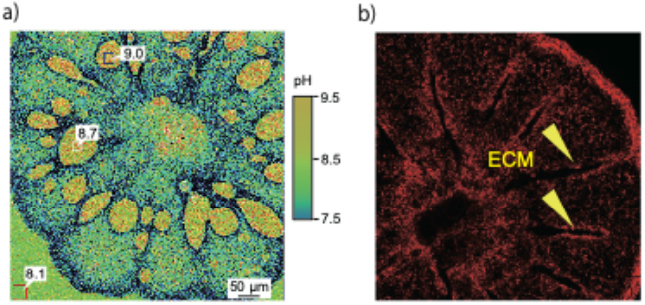
図2 (a)サンゴ幼生におけるECM(細胞外石灰化液)内のpHの可視化(pH指示薬を用いた共焦点レーザー顕微鏡(CLSM)観察)。写真中の数字はpHをそれぞれ示す。ECMのpH8.5から9.0と海水のpH 8.1より0.5から1程度高い。このpH上昇は石灰化を促進させるためだが、ポリアミン輸送体阻害剤を添加するとpH上昇は抑制され、ポリアミンのpH上昇への寄与が示された。(b)サンゴ幼生のECM近傍の造骨細胞内のポリアミンの可視化(ポリアミン染色試薬を用いたCLSM観察)。ECM近傍にはポリアミンを多く含む造骨細胞が集まっている様子が見られた。
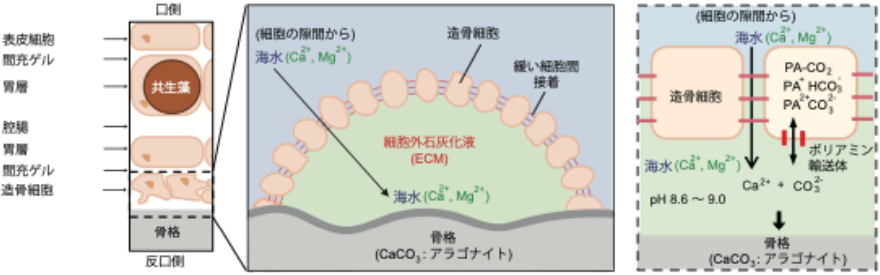
図3 サンゴ組織の模式図とECM(細胞外石灰化液)における骨格形成反応の新仮説。サンゴの炭酸カルシウム骨格は細胞外の石灰化液(ECM)で作られる。材料となるカルシウムは細胞の隙間を通って海水からも供給される。また、サンゴの石灰化プロセスにおいて、ECM内でアルカリ化が起こる。ECMのpHは周囲の海水よりも0.5~1.0高い。この仮説では、無機炭素がポリアミン(PA)と共にポリアミ輸送体を介して移動することで、pHが上昇し、石灰化を促進すると考えられる。
論文名:The Role of Polyamines in pH Regulation in the Extracellular Calcifying Medium of Scleractinian Coral Spats
邦題名:造礁サンゴ幼生の細胞外石灰化液におけるpH調節におけるポリアミンの役割
掲載誌:
Environmental Science & Technology
著者:窪田 梓(日本電子)、大野良和(JST)、安元 純※(琉球大学、総合地球環境学研究所)、飯島真理子※(産業技術総合研究所)、鈴木道生(東京大学)、井口 亮※(産業技術総合研究所)、安元加奈未(東京理科大学)、廣瀬(安元)美奈(トロピカルテクノプラス)、坂田 剛(北里大学)、末弘宗滉(北里大学)、中前華帆(北里大学)、水澤菜々美(北里大学)、神保 充(北里大学)、渡部終五(北里大学)、安元 剛※(北里大学)
※LINKAGEプロジェクト共同研究員
DOI:10.1021/acs.est.4c10097
本研究の一部は、(独)環境再生保全機構の環境研究総合推進費(JPMEERF20194007、JPMEERF20221C01)、(独)日本学術振興会(JSPS)の科研費(19K12310、20H03077、20H00653)、国立研究開発法人産業技術総合研究所・環境調和型産業技術研究ラボ(E-code)、総合地球環境学研究所のLINKAGEプロジェクト、国立研究開発法人 新エネルギー・産業技術総合開発機構(NEDO)の支援を受けて実施しました。