- 質量分析によるグライコプロテオーム解析を加速するソフトウエア「GRable Version 1.0」を開発
- 一つの糖タンパク質の糖鎖付加部位に結合する多様な糖鎖構造の「見える化」を実現
- 創薬シーズ探索や抗体などのバイオ医薬品の品質管理に活用
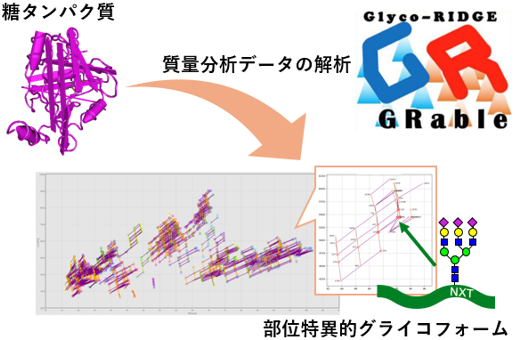
タンパク質上の複数の糖鎖を視覚的に把握できるソフトウエアを開発
※原論文の図を引用・改変したものを使用しています。
国立研究開発法人 産業技術総合研究所(以下「産総研」という) 細胞分子工学研究部門 分子細胞マルチオミクス研究グループの岡谷千晶 主任研究員、富永大介 主任研究員(当時、現:明治薬科大学教授)、富岡あづさ テクニカルスタッフ、坂上弘明 研究員、久野敦 研究グループ長と、名古屋大学 糖鎖生命コア研究所糖鎖ビッグデータセンターの梶裕之 特任教授(兼:産総研 客員研究員)、慶應義塾大学 医学部の洪繁 特任准教授、合田徳夫 特任講師(当時)は、糖鎖が結合したタンパク質の質量分析によるグライコプロテオーム解析データを自動解析できるソフトウエア「GRable Version 1.0(以下、GRable)」を開発しました。糖ペプチドの同定は2段階の質量分析(MS2)による方法が主流ですが、産総研では、1段階の分析(MS1)で糖ペプチドシグナルを特定する方法(Glycan heterogeneity-based Relational IDentification of Glycopeptide signals on Elution profile(Glyco-RIDGE)法)を開発し、MS2による方法よりも網羅性の高い分析を可能としました。本ソフトウエアはGlyco-RIDGE法に基づく質量分析を支援するもので、バイオ医薬品などの特定糖タンパク質の詳細構造解析や、創薬シーズとなり得る糖タンパク質探索のための大規模解析のどちらにも活用できることを実証しました。本ソフトウエアはウェブ公開されており、無償で利用可能です(質量分析によるグライコプロテオーム解析を加速するソフトウエア「GRable」の公開)。なお、この技術の詳細は、2024年9月30日に「Molecular & Cellular Proteomics」に掲載されました。
患者のQuality Of Life(QOL)向上や医療費の抑制のため、早期に疾患を発見し発症前に治療する先制医療や、個人差を踏まえて効果が高く副作用の少ない治療を行う個別化医療の実現が求められています。一方、糖鎖は「細胞の顔」として細胞の状態により変化するため、疾患に伴い糖鎖構造が変化する糖タンパク質は、細胞の病変を鋭敏に反映する目印や機能分子として、先制医療を可能とする診断薬や個別化医療に資する治療薬の開発に利用できます。この疾患に伴う糖鎖変化を利用した糖鎖創薬では、真に病態と関連し、標的となる病変細胞に特異性の高い糖タンパク質(糖鎖・タンパク質の組み合わせ)を同定することが重要です。一方、糖鎖は、タンパク質や核酸と比べて構造が多様かつ複雑で量的に少なく、解析面で大きな障壁があります。グライコプロテオーム解析は、現在主流である、糖ペプチド由来のフラグメントイオン(プロダクトイオン)に基づくMS2ベースの解析法では、信頼性の高い糖ペプチドの同定が可能である一方、解析に十分なMS2スペクトルが取得されないと糖ペプチドが同定できず、網羅性に課題がありました。
産総研では、レクチンを用いた簡便・高感度な糖鎖プロファイリング技術および質量分析を用いた詳細構造解析技術の開発に取り組み、それらを組み合わせたマルチモーダル糖鎖解析プラットフォームを構築してきました(参考文献1)。糖タンパク質を治療標的とする場合には、抗体などの標的プローブの作製にあたり、どの位置にどのような糖鎖が付加しているか(部位特異的グライコフォーム)を知ることが重要です。しかし、糖鎖の構造の多様性および複雑性から、詳細構造解析は非常に難易度が高く、網羅性と精度を兼ね備えた解析法が求められています。この課題を解決するため、産総研では、独自の部位特異的グライコフォーム解析法としてGlyco-RIDGE法を開発してきました(参考文献2、図1)。本研究では、糖鎖解析プラットフォームの要素技術として、質量分析によるグライコプロテオーム解析を加速するためのソフトウエア「GRable」を開発しました。なお、本研究開発は、国立研究開発法人 日本医療研究開発機構の次世代治療・診断実現のための創薬基盤技術開発事業 「糖鎖利用による革新的創薬技術開発事業(2016~2020年度)」による支援を受け実施しました。
現在主流のMS2ベースの解析法とは異なり、Glyco-RIDGE法はMS1ベースの解析法であるという特徴を有しています。液体クロマトグラフィーにおける溶出プロファイルおよびMS1質量の差分に基づき、糖ペプチドをクラスターとして検出することで、断片化が必要なMS2ベースの解析法よりも微量の糖ペプチドを検出できます(図1A、B)。MS2ベースの解析法では、糖ペプチド由来のフラグメントイオンによりペプチド配列を同定しますが、Glyco-RIDGE法では、MS2ベースの解析法で取得したペプチド配列のリストを用いることで、クラスターとして検出された糖ペプチドのペプチド配列を推定します(図1C)。本手法では、断片化を行わず糖ペプチドを検出するため、MS2による方法よりも網羅性を高められます。
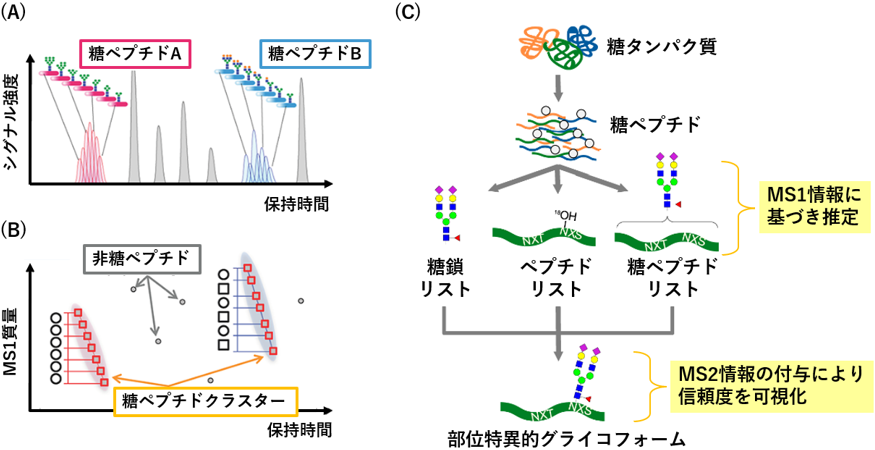
図1 Glyco-RIDGE法の原理および本ソフトウエアでの改良点
同一のペプチド配列を有する糖ペプチド群は、液体クロマトグラフィーにおいて類似した保持時間を有します(A)。そこで、一定範囲内の保持時間および糖ユニットの質量に相当する質量差を有するシグナル群を糖ペプチド由来とみなし、クラスターとして検出します(B)。このようにMS1情報に基づき検出した糖ペプチドのリストを、別途用意したペプチドリストおよび糖鎖リストと網羅的に突き合わせることで、正しい組み合わせ(部位特異的グライコフォーム)を推定し、MS2情報を付与することで信頼度が分かるようにしました(C)。
※原論文と参考文献2の図を引用・改変したものを使用しています。
本研究では、糖鎖解析プラットフォームの要素技術として、質量分析によるグライコプロテオーム解析を加速するため、Glyco-RIDGE法に基づくグライコプロテオーム解析を自動化するソフトウエア「GRable」を開発しました。GRableでは、ビューワーにて検出した糖ペプチドクラスターを可視化することで、サンプル中の糖ペプチドの多様性を視覚的に把握できる工夫をしています(図2)。
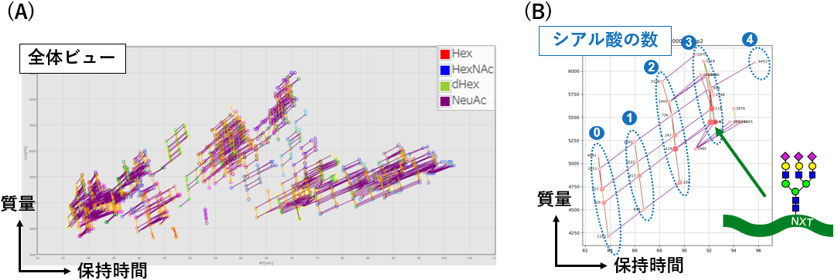
図2 GRableによる糖ペプチドの可視化
特定糖タンパク質(human α1-acid glycoprotein;AGP)分析におけるサンプル全体(A)および特定のペプチド(B)における部位特異的グライコフォームを2次元プロットで表示しています。付加するシアル酸の数が異なる糖ペプチドも同一クラスターとして検出可能です(B)。
※原論文の図を引用・改変したものを使用しています。
モデル試料を用いた質量分析データの解析に本ソフトウエアを活用することで、本ソフトウエアが特定糖タンパク質の詳細構造解析および複数の糖タンパク質が混合された試料(クルード試料)の大規模解析に利用できることを示しました。特に、一残基のみ異なるペプチドを有するアイソフォームの部位特異的グライコフォームも個別に検出できることを実証しました(図3)。
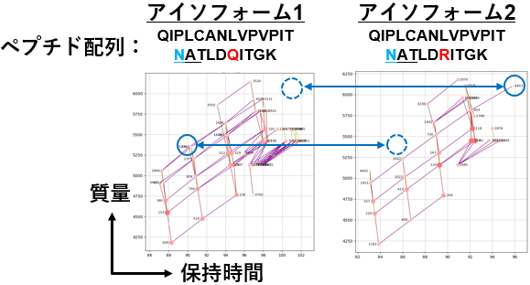
図3 GRableによるアイソフォームの識別
特定糖タンパク質(AGP)の二つのアイソフォームを個別に検出することで、丸で示したグライコフォームの有無が異なることが明らかになりました。
※原論文の図を引用・改変したものを使用しています。
MS1ベースの解析法の課題として、断片化を行わず糖ペプチドを検出するため、信頼性の指標である偽発見率(false discovery rate)が算出できないという問題がありました。そこでGRableでは、帰属された各糖ペプチドに対し、糖ペプチド由来のフラグメントイオンなどのMS2情報を付与する機能を搭載することで、解析結果の確からしさ(信頼レベル)を可視化できるようにしました(図1C)。
また、同一の特定糖タンパク質の質量分析データを用いて、市販のMS2ベースの解析ソフトウエアと比較評価したところ、GRableでは、約4倍の部位特異的グライコフォームが推定され、GRableを用いることで網羅性の高い解析が実現できることを実証しました。
以上より、本研究では、既存のMS2ベースの解析法では検出できなかった微量の糖ペプチドをも検出できるMS1ベースのGlyco-RIDGE法を解析自動化するソフトウエアを開発することで、より網羅的な部位特異的グライコフォーム解析を実現しました。
本ソフトウエアは、創薬シーズの探索に活用することで糖鎖創薬の開発を加速すると期待できます。また、遺伝子治療のためのウイルスベクターの糖鎖解析への使用実績もあり(参考文献3)、抗体だけでなく新しいモダリティーのバイオ医薬品の品質管理への活用も期待できます。今後、産総研では、それぞれの利点を有するMS1ベースの解析法(Glyco-RIDGE法)と従来のMS2ベースの解析法をより効果的に統合し、網羅性と信頼性を改善した解析法とそのソフトウエアの開発を進めます。また、グライコプロテオーム解析の高度化に加え、マルチモーダル糖鎖解析プラットフォームをより強固にするための要素技術として、新たな糖鎖解析技術の開発にも取り組みます。名古屋大学糖鎖生命コア研究所では、ヒューマングライコームプロジェクト(参考文献4)において本技術も活用していくことで、ヒトの身体に存在する糖鎖の正確な構造を網羅的に明らかにします。
掲載誌:Molecular & Cellular Proteomics
論文タイトル:GRable version 1.0: A software tool for site-specific glycoform analysis with improved MS1-based glycopeptide detection with parallel clustering and confidence evaluation with MS2 information
著者:Chiaki Nagai-Okatani*, Daisuke Tominaga, Azusa Tomioka, Hiroaki Sakaue, Norio Goda, Shigeru Ko, Atsushi Kuno, Hiroyuki Kaji*(*:責任著者)
DOI:10.1016/j.mcpro.2024.100833