国立研究開発法人 産業技術総合研究所(以下「産総研」という)触媒化学融合研究センター 川波肇 上級主任研究員は、国立大学法人 筑波大学大学院 数理物質科学研究群化学学位プログラムの大野聖海(博士後期課程)と共同で、二酸化炭素と水素から高効率で直接ギ酸を合成する技術を開発しました。
ギ酸は、水素キャリアとして注目されている化合物です。従来法では、二酸化炭素と水素から、塩基性条件下で安定なギ酸“塩”とした後に、酸処理によってギ酸に変換していました。しかし、酸処理により発生する熱や生成する塩の除去など複数の工程が必要で、ギ酸の製造コストが高く、将来的に目標とされる価格帯での水素供給が難しいという課題がありました。今回、ヘキサフルオロイソプロパノール(HFIP)中で、イリジウム触媒を使って二酸化炭素と水素から簡単にギ酸を直接合成する方法を開発しました。これまで、イリジウム触媒が存在していると、水中ではギ酸はすぐに水素と二酸化炭素に分解してしまうため、直接ギ酸を合成することは困難でした。これに対し、HFIPがギ酸の分解を抑制し、さらにギ酸中間体(イリジウムヒドリド錯体)の生成速度が水中の場合と比較して4倍以上も速いことを見いだしました。この発見により、ギ酸塩を経由しなくても効率的に直接ギ酸を合成することが可能になりました。
また、この成果は、産総研が開発したフロー式によるギ酸からの水素を用いた発電システムと組み合わせることで、システムから排出される液化二酸化炭素と再生可能エネルギーなどから得られる水素を用いてギ酸を再生できるので、ギ酸の水素キャリアとしての活用につながることが期待できます。
なお、この技術の詳細は、2024年9月24日に「Organometallics」に掲載されました。
2050年までに温室効果ガス排出をゼロにするカーボンニュートラルな社会を目指す中、水素をエネルギーとして利用する取り組みが進んでいます。この取り組みに向けて、水素を貯蔵し、運搬し、製造するために、国内では高圧および液体水素、そしてメチルシクロヘキサンなどの有機系水素キャリアを利用した技術開発が進んでいます。例えば海外で褐炭から製造した水素を液体水素として日本へ運搬し、燃料電池を利用した車、電車、フォークリフトなどで使う実証試験が行われています。
一方で、例えば高圧および液体水素の場合、貯蔵・運搬には重い容器を使った特殊な設備が必要なため、広範囲に搬送・保存するための安全性やコスト面での課題がありました。
ギ酸は安定な有機液体で、樹脂容器などを使って室温で安全に貯蔵・運搬が可能であるため、水素を貯蔵・運搬・製造する媒体(水素キャリア)として注目されています。私たちは、ギ酸を水素キャリアとして活用できるシステムを構築するために、圧縮機を使わない高圧水素連続供給法(2015年12月11日 産総研プレス発表)や、フロー式によるギ酸からの連続発電システム(2023年10月20日 産総研プレス発表)といったギ酸から水素を製造・利用する技術の開発を進めてきました。一方で、ギ酸を分解して水素を製造するときには、液化二酸化炭素が生成します。この液化二酸化炭素を回収しギ酸合成に利用することができれば、二酸化炭素を排出せずに、ギ酸を使って水素を貯蔵・製造するシステムの構築が可能になり、水素社会の実現に貢献できると考えています。
ギ酸は工業的には一酸化炭素とメタノールから製造されるギ酸塩を酸性にすることで製造されます。また、研究室レベルでは二酸化炭素と水素からギ酸塩を合成する技術が多数報告されています。しかし、ギ酸塩は水素製造には直接利用できないため、ギ酸に変換する必要があります。これにはコストや手間がかかり、水素キャリアとして利用するには不向きでした。そのため、水素と二酸化炭素から、ギ酸を直接合成する技術が必要でした。今回、HFIPを溶媒に用いることで、回収される二酸化炭素と水素から直接ギ酸を合成する技術を開発しました(図1の赤枠)。
これまでに開発した技術(圧縮機を使わない高圧水素連続供給法およびフロー式によるギ酸からの連続発電)と、今回開発した、回収した二酸化炭素から高圧水素源のギ酸を再生させる技術を組み合わせることによって、二酸化炭素を循環させ排出せずに、ギ酸を水素キャリアとして使用することが可能となります(図1)。
なお、本研究開発は、キヤノン財団の第12回研究助成プログラム「新産業を生む科学技術」(2021~2023年度)による支援を受けました。
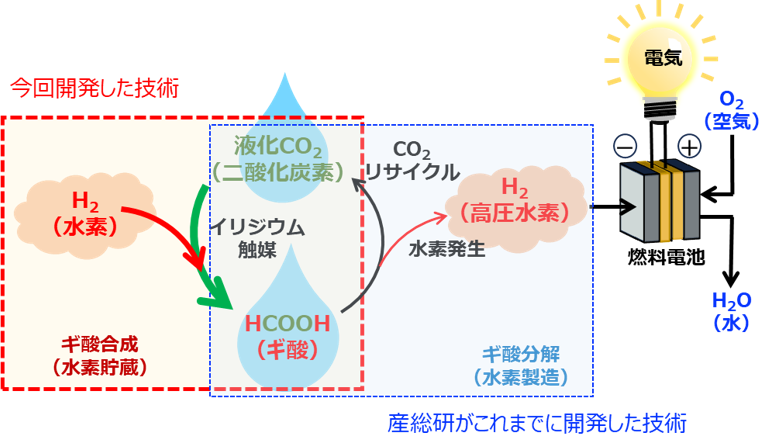
図1 二酸化炭素が循環しつつギ酸を水素キャリアとして利用するシステムの概要
ギ酸から水素1 kgを取り出すと、理論上22 kgの二酸化炭素が副生します。そのためギ酸を水素キャリアとして無駄なく利用するには、水素だけでなく、二酸化炭素を回収して利用する技術も必要です。私たちは、ギ酸から得られた水素と二酸化炭素を分離し、高圧水素と液化二酸化炭素として回収する技術をこれまでに開発してきました。そこで、この回収した純度の高い液化二酸化炭素を排出せずに、積極的に利用する手段、すなわち水素と二酸化炭素から再びギ酸を合成する技術の開発を進めてきました。しかし、ギ酸塩を合成する技術は多くあるものの、ギ酸を直接合成する技術の開発は十分ではありませんでした。
水素と二酸化炭素から直接ギ酸を合成するためには、高効率でギ酸を生成すると同時に、生成したギ酸が分解して水素と二酸化炭素に戻る反応を抑制することが必要です(図2左)。技術開発のきっかけは、イリジウム触媒存在下、各種溶媒中でギ酸が水素と二酸化炭素に分解し、高圧ガスが生成する速度を測定していたところ、溶媒によってその速度が大きく変化することを見いだした点にあります。その中でもHFIP中では、ギ酸の分解速度が水中の場合と比べて2分の1に遅くなることが分かりました。しかも、高圧ガス生成も水中では37.9 MPaであるのに比べてHFIP中では1.20 MPaと、約32分の1の圧力しか出ないことが分かりました。一方、ギ酸の合成については、水の場合よりHFIPの場合の方が水素と二酸化炭素からの反応中間体(イリジウムヒドリド錯体)の生成速度が4倍速く(図2右)、全体としてギ酸の生成速度が1.5倍以上速くなり、ギ酸の生成量も3.5倍多いことが分かりました。
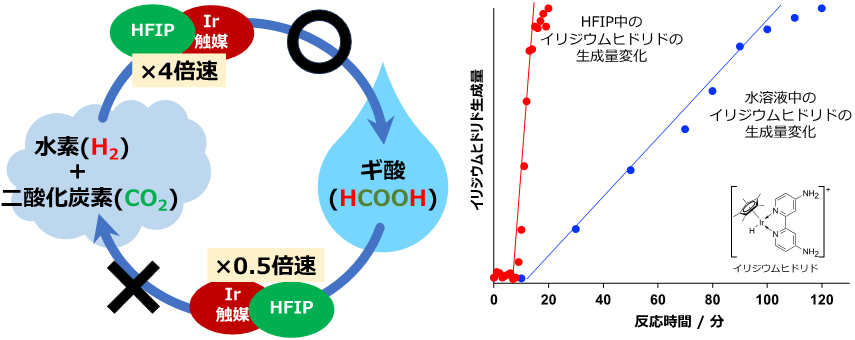
図2 水素と二酸化炭素およびギ酸の反応サイクル(左)と、媒体に水(青)とHFIP(赤)を用いた場合でのイリジウムヒドリド錯体の生成速度の違い(右)
動画 ギ酸水溶液中でのギ酸脱水素化の様子(泡が勢いよく出ている)とギ酸HFIP溶液中でのギ酸脱水素化の様子(反応が抑制されていて、少ししか泡が出ない)。いずれも50 ℃での反応の様子。
これらの発見から二酸化炭素と水素から直接ギ酸を効率的に合成する手法を考案し、ギ酸を水素キャリアとして活用するシステムの中で再生する本技術の開発に至りました。
今回の開発により、研究室レベルで、水素を二酸化炭素と反応させてギ酸へと変換して“貯蔵”し、そのギ酸から高圧水素(“製造”)と二酸化炭素を発生させ、さらに回収した二酸化炭素を用いてギ酸を合成するシステムのコンセプトが実証できました。今後は、研究室スケールでの概念実証レベルから、ベンチプラントスケール、パイロットスケールへのスケールアップが必要です。そのため、2030年の社会実装に向けて、実証実験を進めていく予定です。
また、現在、ギ酸は、今回の触媒を用いた合成法だけでなく、電気化学的な合成法、バイオマスやバイオガスからの合成法など、さまざまな合成技術が開発されており、将来はこれらの技術で合成されたギ酸も含めて水素キャリアとして利用するシステム全体の構築を目指していきます。
掲載誌:Organometallics
論文タイトル:Direct formic acid production by CO2 hydrogenation with Ir complexes in HFIP under supercritical conditions
著者:Seo Ono, Ryoichi Kanega, Hajime Kawanami
DOI:doi.org/10.1021/acs.organomet.4c00229