- 胃のムチン(粘液)産生に関わるMUC6遺伝子の変異は胃癌の10%程度で見られるが、どのように発癌と関わるかは不明でした。本研究では、MUC6遺伝子変異によるMUC6喪失がゴルジ体ストレスを介して癌化を引き起こすという、新しい胃癌発生メカニズムを証明しました。
- MUC6遺伝子変異を伴う胃癌ではマンノースという異常な糖鎖が高発現することを発見し、マンノースに強く結合するバナナ由来の薬物複合体を用いた新規治療薬を開発、その治療効果を実験系で確認しました。
- ムチン遺伝子変異の機能やゴルジ体ストレスとの関連、さらには異常糖鎖に着目した新規薬物複合体など、幅広い分野にわたって新規性の高い重要な成果が含まれており、バナナ由来化合物の実臨床への応用の可能性も期待されます。
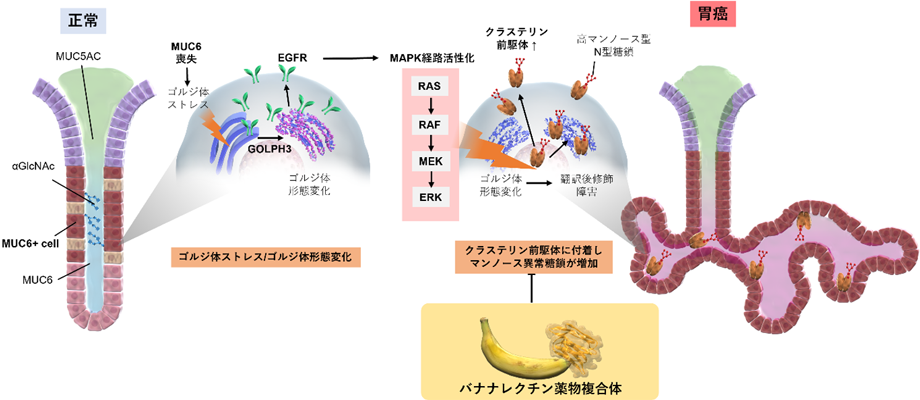
MUC6遺伝子変異に伴う胃癌発癌メカニズム、および治療戦略の提案
東京大学医学部附属病院 消化器内科 新井絢也 医師、早河翼 講師、藤城光弘 教授と、国立研究開発法人産業技術総合研究所 細胞分子工学研究部門 多細胞システム制御研究グループ 舘野浩章 研究グループ長らによる研究グループは、ムチン(粘液)の一種であるMUC6(注1)の喪失が直接胃癌の発生を引き起こすことを明らかにしました。
本研究では独自に作成したMUC6ノックアウトマウス(以下MUC6KOマウス)を用いて、MUC6喪失により胃癌が自然に発生することを見出し、その発癌経路としてゴルジ体(注2)のストレス(注3)を介したGOLPH3遺伝子(注4)-MAPK経路(注5)の活性化を同定し、それに付随してマンノース異常糖鎖(注6)が高発現となることを世界で初めて示しました(図1)。
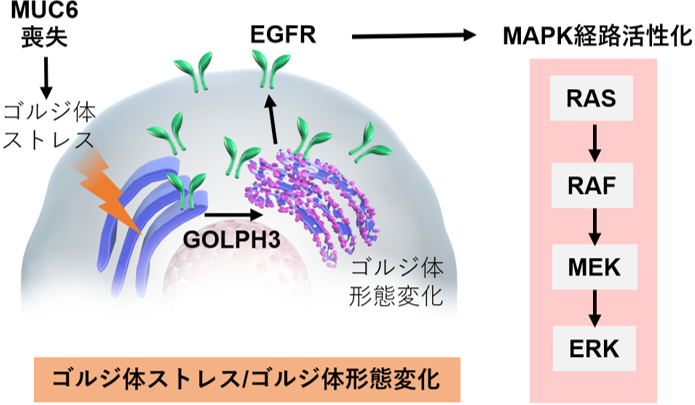
図1:MUC6変異に伴う発癌経路の概略
元来ムチン形質変化は発癌に付随して変化した結果と考えられてきましたが、今回MUC6喪失自体により直接胃癌が発生することを示したことは新しい胃癌発生メカニズムの発見として重要な意味があり、この研究成果は今後そのほかのムチン形質変化による多種多様な疾患への関与の解析につながることが期待されます。
ピロリ菌除菌療法の普及・感染率の低下により胃癌患者数のゆるやかな減少が見られていますが、依然として胃癌による死亡者数は癌死亡者数全体の上位を占めています。手術のできない進行胃癌は既存の薬物療法に対し抵抗性を示すことが多いため、新規発癌経路の同定、新規治療標的の探索が待たれています。
近年胃癌の全ゲノム解析の結果が報告され、MUC6遺伝子変異が胃癌の10%程度で見られました。MUC6遺伝子変異を有する胃癌は、治療抵抗性を示しやすく、予後不良であることがこれまで報告されてきましたが、胃癌発生への関与は不明とされてきました。
この度、本研究グループは独自にMUC6遺伝子を欠損・無効化させたMUC6KOマウスを作成し、MUC6喪失により直接胃癌発生が引き起こされることを世界で初めて発見し、その発癌経路、新規治療標的の提案を行いました。
MUC6KOマウスは、3か月齢程度で異形成を示し、半年齢以降全個体で胃癌が観察され、12か月齢では粘膜下に浸潤する浸潤癌を呈しました。その発癌経路として、RNAシークエンス(注7)等の解析によりMAPK経路活性化が同定され、MEK阻害薬(注8)で腫瘍が著明に縮小することが判明しました(図2)。
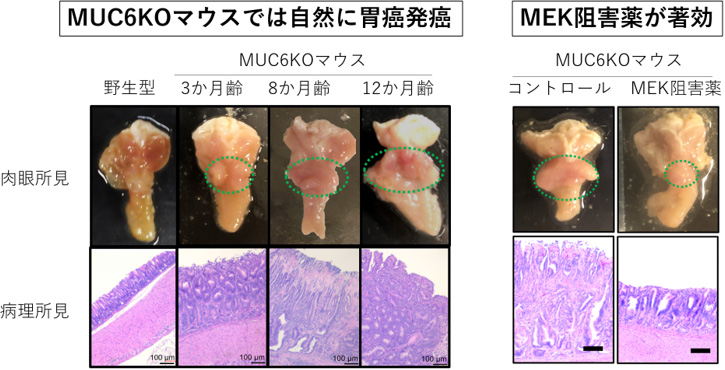
図2:MUC6KOマウスにおいて胃癌が自然発癌し、MEK阻害薬で腫瘍が縮小する。
(左)MUC6KOマウスは3か月齢程度で異形成を示し、8か月齢では発癌、12か月齢では粘膜下浸潤癌を呈していた。
(右)MEK阻害薬を投与するとMUC6KOマウスの腫瘍は縮小した。
スケールバーは100 μmを示す。
電子顕微鏡で細胞小器官を観察すると、ゴルジ体の形態変化(膜同士の距離が広がり全体として膨張)が見られ、それに付随してゴルジ体ストレスマーカーであるGOLPH3遺伝子が高発現していることが判明しました。そこでGOLPH3のノックアウトマウスを用いてGOLPH3遺伝子の発現を低下させると、MAPK経路活性の低下、腫瘍縮小が観察されたことから、MUC6KOマウスにおける発癌経路は、ゴルジ体ストレスを介したGOLPH3遺伝子-MAPK経路の活性化であることが示されました(図3)。
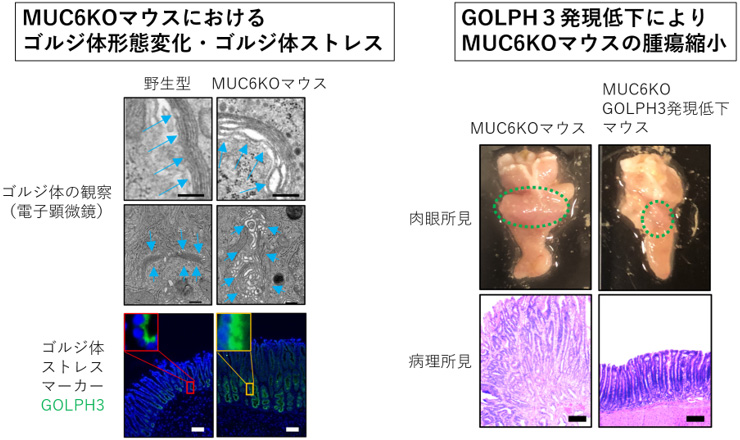
図3:MUC6KOマウスにおけるゴルジ体形態変化およびゴルジ体ストレス
(左)MUC6KOマウスでは、電子顕微鏡で細胞小器官を観察するとゴルジ体の形態変化が観察され、ゴルジ体ストレスマーカーであるGOLPH3遺伝子の高発現を認めた。
(右)GOLPH3の発現を低下させる、MUC6KO-GOLPH3ヘテロ マウスを作成すると、腫瘍は縮小した。
スケールバーは100 μmを示す。
さらに、ゴルジ体ストレスに付随してMUC6KOマウスにおける腫瘍部分ではマンノースという異常糖鎖が高発現していることが、レクチン(注9)解析、糖鎖の質量分析により判明しました(図4左)。GOLPH3-MAPK経路の異常およびマンノースの高発現は、MUC6遺伝子変異を伴うヒト胃癌患者の細胞・検体でも確認されました。
この癌細胞だけに発現する異常マンノース糖鎖に着目した本研究グループは、マンノースに特異的に接着する新規レクチン薬物複合体を開発しました。バナナ由来のレクチンに遺伝子改変を施し、リンカ―を介して緑膿菌外毒素を接着させた、バナナレクチン薬物複合体です。その結果、MUC6KOマウス、またMUC6喪失を伴うヒト胃癌細胞株を用いた
ゼノグラフト(注10)において、このバナナレクチン薬物複合体は腫瘍縮小効果を認めました(図4右)。
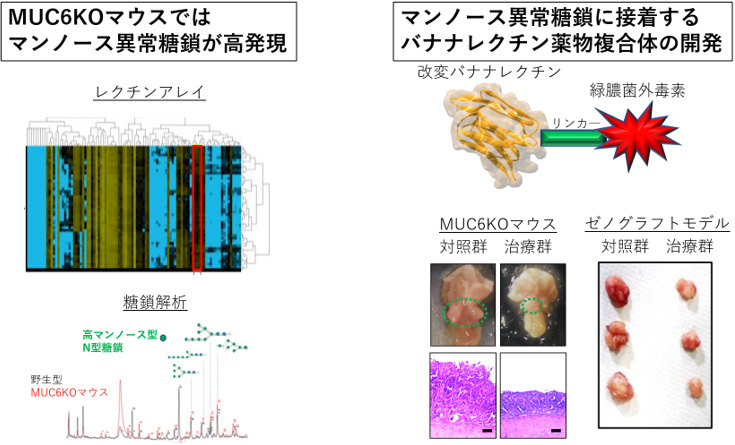
図4:MUC6KOマウスにおけるマンノース異常糖鎖の高発現、およびバナナレクチン薬物複合体の開発
(左)レクチンアレイ、糖鎖解析により、MUC6KOマウスではマンノース異常糖鎖が増加していることが示された。
(右)マンノースに特異的に接着するバナナレクチン薬物複合体を開発し、マウスモデル、ゼノグラフトモデルで治療効果を立証した。
スケールバーは100 μmを示す。
以上の研究成果により、MUC6喪失に伴う新しい胃癌の発生メカニズムとしてゴルジ体ストレスを介したGOLPH3遺伝子-MAPK経路の活性化を見出しました。さらに治療標的として異常糖鎖に着目したバナナ由来レクチン薬物複合体を提案しました。これまでもムチン遺伝子変異、糖鎖転移酵素遺伝子変異による、種々の臓器における多種多様な疾患に対する関与が示されてきましたが、そのメカニズムは不明でした。今回の研究成果により、より幅広い疾患におけるゴルジ体ストレス、GOLPH3遺伝子の関与の検証がされ、その治療標的として、異常糖鎖に着目したレクチン薬物複合体の活用が期待されます。
国立大学法人 東京大学
医学部附属病院 消化器内科
新井 絢也 届出研究員
兼:公益財団法人 朝日生命成人病研究所 消化器科 主任研究員
医学部
早河 翼 講師
兼:東京大学医学部附属病院 消化器内科
大学院医学系研究科 消化器内科学
藤城 光弘 教授
兼:東京大学医学部附属病院 消化器内科 科長
国立研究開発法人 産業技術総合研究所
細胞分子工学研究部門 多細胞システム制御研究グループ
舘野 浩章 研究グループ長
雑誌名:
Gastroenterology
題名:Impaired glycosylation of gastric mucins drives gastric tumorigenesis and serves as a novel therapeutic target.
著者名:Junya Arai; Yoku Hayakawa*; Hiroaki Tateno*; Keita Murakami; Takeru Hayash; Masahiro Hata; Yuki Matsushita; Hiroto Kinoshita; Sohei Abe; Ken Kurokawa; Yukiko Oya; Mayo Tsuboi; Sozaburo Ihara; Ryota Niikura; Nobumi Suzuki; Yusuke Iwata; Toshiro Shiokawa; Chihiro Shiomi; Chie Uekura; Keisuke Yamamoto; Hiroaki Fujiwara; Satoshi Kawamura; Hayato Nakagawa; Seiya Mizuno; Takashi Kudo; Satoru Takahashi; Tetsuo Ushiku; Yoshihiro Hirata; Chifumi Fujii; Jun Nakayama; Shinsuke Shibata; Susan Woods; Daniel L. Worthley; Masanori Hatakeyama; Timothy C. Wang; and Mitsuhiro Fujishiro
(*:責任著者)
DOI:10.1053/j.gastro.2024.03.037
URL:
https://doi.org/10.1053/j.gastro.2024.03.037
本研究は、科研費「23H02744, 23K07448」の支援により実施されました。