近畿大学生物理工学部(和歌山県紀の川市)教授 財津桂、国立研究開発法人 産業技術総合研究所(茨城県つくば市)主任研究員 井口亮、田辺三菱製薬株式会社(神奈川県藤沢市)主任研究員 日比野優衣の研究グループは、メタボローム解析※2と生物情報科学※3を用いて、医薬品などの副作用として生じる薬物性肝障害※4の要因となる、ミトコンドリア毒性の機序を判別するための指標分子を明らかにしました。本研究成果は、今後、創薬研究における医薬品の新たな毒性評価法確立への応用が期待されます。
本研究成果は令和4年(2022年)12月1日(木)AM8:45(日本時間)に、毒性学に関する国際的な学術誌“Toxicology and Applied Pharmacology”に掲載されます。

メタボローム解析と生物情報科学を用いたミトコンドリア毒性機序判別のイメージ図
薬物性肝障害とは、医薬品などの副作用として生じる肝臓の炎症です。医薬品を服用した患者に薬物性肝障害が見つかると、発売中止や、新薬開発の中断などにつながるため、薬物性肝障害のリスクを適切に予測することが重要です。
薬物性肝障害の主な原因の一つとして、ミトコンドリア毒性が挙げられます。ミトコンドリアは細胞内小器官の一つであり、細胞の「エネルギー生産工場」ともいわれます。このミトコンドリアに対して、機能障害をもたらす性質をミトコンドリア毒性といいます。
従来、薬剤のミトコンドリア毒性は、薬剤を培養細胞に曝露し、ミトコンドリアの形態を観察することや、細胞の酸素消費量を測定することで評価されてきましたが、薬物性肝障害のリスク予測にはミトコンドリア毒性の機序を判別する必要があり、従来の評価法では不十分でした。より厳密にミトコンドリア毒性の機序を判別するためには、分子プロファイル※5を利用した評価法の確立が不可欠です。そこで、本研究グループでは、メタボローム解析と生物情報科学を融合した、新たな技術の開発を進めてきました。
研究グループは、ミトコンドリア毒性の機序判別の指標となる分子の特定を目的として、毒性機序が異なる4種類の化合物をヒト肝がん由来細胞株(HepG2細胞)に曝露し、メタボローム解析を行った結果、125成分の代謝物を同定しました。生物情報科学を用いて解析したところ、ミトコンドリア毒性の機序が異なると、この125成分の分子プロファイルが大きく異なることを明らかにしました。
さらに、生物情報科学を用いて50成分の分子を絞り込み、機械学習によって検証した結果、この50成分がミトコンドリア毒性の機序を識別する指標分子※6となり得ることが分かり、この指標分子を用いることで、ミトコンドリア毒性の機序を判別できる可能性が示されました。
本研究は、メタボローム解析によるミトコンドリア毒性機序を識別するための、ブレークスルーとなる成果です。また、本研究で明らかになった指標分子は、今後、創薬研究において医薬品の新たな毒性評価法確立への応用などが期待されます。
掲載誌:
Toxicology and Applied Pharmacology
(インパクトファクター: 4.46@2021)
論文名:Preliminary study to classify mechanisms of mitochondrial toxicity by
in vitro metabolomics and bioinformatics
(in vitroメタボロミクスとバイオインフォマティクスによるミトコンドリア毒性メカニズムの分類のための予備的研究)
著者:日比野優衣
1、井口亮
2、財津桂
3* *責任著者
所属:1 田辺三菱製薬株式会社、2 国立研究開発法人 産業技術総合研究所、3 近畿大学生物理工学部
本研究では、ヒト肝がん由来細胞株のHepG2細胞に、毒性機序が異なるミトコンドリア毒性化合物(ロテノン、ネファゾドン、CCCP、ペルヘキシリン)および陽性対照化合物(ジギトニン)を曝露し、それらのメタボローム解析を行い、得られた多変量データに対して生物情報科学(バイオインフォマティクス)を適用し、ミトコンドリア毒性機序の判別に寄与する分子の特定を試みました。
細胞を用いて肝障害などの評価を行う際には、細胞の培養や継代が容易なヒト肝がん由来細胞株が用いられることが一般的です。しかし、がん由来の細胞では通常の細胞と異なり、好気的解糖(Warburg効果)が亢進しているといわれています。つまり、がん由来の細胞では、解糖系の方が亢進しており、ミトコンドリア内のTCA回路を介したATP産生が抑制される傾向にあります。従って、ヒト肝がん由来細胞株のHepG2細胞を用いてミトコンドリア毒性の分子プロファイルを解析するためには、がん細胞で生じるWarburg効果を抑制することが重要です。
そこで本研究では、先行研究を参考にHepG2細胞の培養条件を通常のグルコース培地からガラクトース培地に変更することで、Warburg効果を抑制しました。また、各化合物の曝露濃度については、予め細胞毒性とATP産生量を同時に評価することができるMitochondrial ToxGlo Assayを用いて、細胞毒性が概ね観察されない条件で、かつ、ATP産生量が50%程度に低下する濃度に最適化しました。
この最適化した濃度において各化合物を曝露したHepG2細胞(各n=15)に加え、コントロールとして溶媒(DMSO)のみを曝露したHepG2細胞(n=15)についてメタボローム解析を実施した結果、125成分の代謝物が同定されました。得られたメタボロームデータに対して、多変量解析の一つである潜在構造投影判別分析(PLS-DA)※7を行いました。この結果を図1に示します。
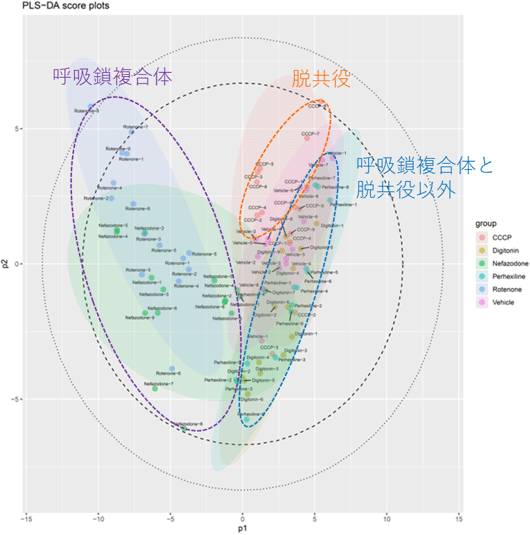
図1 各化合物を曝露したHepG2細胞、溶媒(DMSO)のみを曝露したHepG2細胞のメタボローム解析から得られたデータに多変量解析(PLS-DA)を行った結果
青色と緑色で示された円は呼吸鎖複合体阻害(ロテノン、ネファゾドン)、オレンジ色で示された円は脱共役(CCCP)のグループを示す。呼吸鎖複合体(紫色の破線で囲んだもの)、脱共役(オレンジ色の破線で囲んだもの)は、β酸化阻害(ペルヘキシリン)、陽性対照(ジギトニン)および溶媒(DMSO)のグループ(赤色の破線で囲んだもの)と良好に分離しており、これらの分子プロファイルが異なることを意味する。
図1の結果から、呼吸鎖複合体阻害(ロテノンおよびネファゾドン)および脱共役(CCCP)の分子プロファイルは他群と良好に分離しており、分子プロファイルが異なることが示されました。一方で、β酸化阻害(ペルヘキシリン)については、陽性対照(ジギトニン)および溶媒(DMSO)のみを曝露したグループと明確に分離されませんでした。この理由としては、本研究で用いた細胞培養の条件ではβ酸化経路に必要な脂肪酸の供給が十分ではなく、β酸化阻害の影響が評価されにくかったことが考えられました。
さらに、ミトコンドリアにおけるエネルギー産生に関連する解糖系、TCA回路を中心とした代謝パスウェイ解析※8を行った結果を図2に示します。
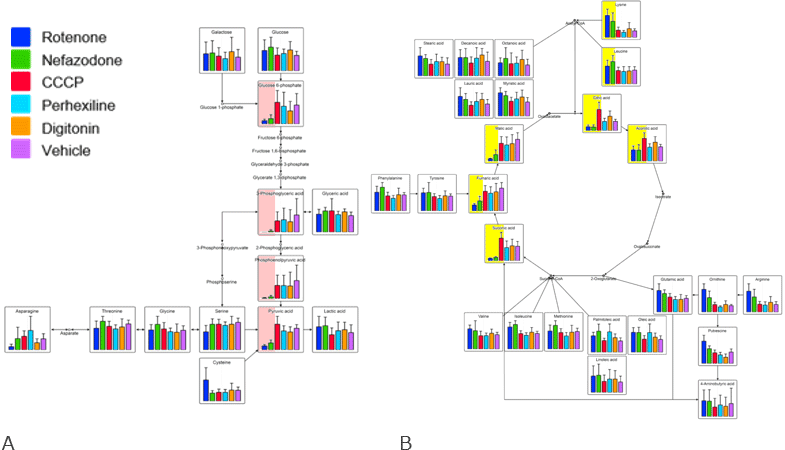
図2 代謝パスウェイ解析の結果(A:解糖系、B:TCA回路)
青色と緑色で示す呼吸鎖複合体阻害(ロテノンおよびネファゾドン)は、解糖系(A)において、グルコース6リン酸からピルビン酸までの経路(Aの赤色背景の箇所)および TCA回路等(Bの黄色背景の箇所)で低値を示した。一方、脱共役(CCCP)はTCA回路の一部(Bの黄色背景の一部)で高値を示した。
代謝パスウェイ解析の結果からも、呼吸鎖複合体阻害(ロテノンおよびネファゾドン)および脱共役(CCCP)は解糖系やTCA回路の構成分子の挙動が、明らかに他のグループと異なることが確認されました。
以上の結果から、Warburg効果を抑制したHepG2細胞にメタボローム解析を適用すれば、呼吸鎖阻害および脱共役という、異なるミトコンドリア毒性機序を分子レベルで識別できることが明らかとなりました。
さらに、ミトコンドリア毒性機序を判別するために有用な分子をPLS-DAから50成分に絞り込み、この50成分を用いて機械学習の一つであるRandom Forest※9による判別モデルを検証した結果、各グループの識別精度は、ロテノンが0.94、ネファゾドンが0.87、CCCPが0.93、ペルヘキシリンが0.90、ジギトニンが0.83、溶媒(DMSO)が0.94を示したことから、これら50成分を「指標分子」とすれば、ミトコンドリア毒性機序を識別できる可能性があることも明らかにしました。
また、得られた多変量データに対してデータ駆動型解析の一つである相関ネットワーク解析※10を行いました。この結果を図3に示します。
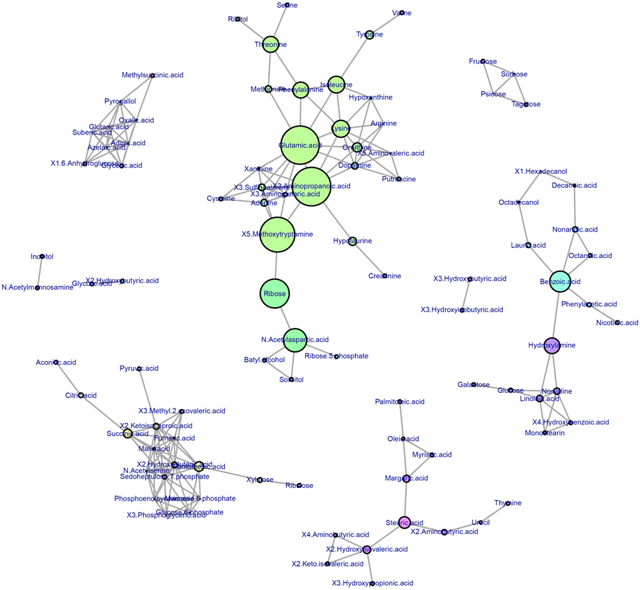
図3 相関ネットワーク解析の結果
ここでは相関係数(R)>0.75を基準に設定した。各ノード(円)の大きさは媒介中心性指標に応じてサイズが大きく示されている。
相関ネットワーク解析の結果から得られる媒介中心性指標を用いることで、代謝ネットワーク内において影響力を持つ「ハブ分子」を可視化できます。ここでは、コハク酸、3-アミノプロパン酸、グルタミン酸がハブ分子として特定され、これらのハブ分子は呼吸鎖複合体阻害と脱共役の、より明確な指標分子となり得ることが明らかとなりました。
本研究はメタボローム解析によるミトコンドリア毒性機序を識別するためのブレークスルーとなるものです。また、本研究で示された指標分子は今後、創薬における新たな毒性評価法に応用できる可能性が高く、創薬研究において大いに活用されることが期待されます。