京都府立医科大学大学院医学研究科分子標的予防医学の渡邉元樹講師と関西医科大学附属病院がんセンターの朴将源センター助教、国立研究開発法人 産業技術総合研究所の亀田倫史上級主任研究員らの研究チームが、「タンパク質の構造に着目した新しい創薬スクリーニング法の開発及びMEK阻害剤の耐性カニズムの解明」を行い、本件に関する論文が、科学雑誌『PNAS nexus』に2022年5月16日(現地時間)付けで掲載されましたのでお知らせします。
近年、ゲノム解析によりがんの遺伝子異常が見出されていますが、遺伝子異常が直接の原因ではない、タンパク質の異常の蓄積ががんの増殖や進展に影響することがわかってきています。そのため、私たちは、がん細胞内で結合し、がんの増殖を強力に抑える天然植物由来成分のタンパク質を研究してきましたが、天然物をそのまま薬剤として使用できない課題がありました。今回私たちは、がん細胞の増殖抑制作用をもつ天然植物成分として知られる、シソやハーブの成分であるペリリルアルコールとゴマ由来のセサミノールの双方に結合するタンパク質として、リボソームタンパク質の一種であるRPS5 (ribosomal protein S5)を同定しました。さらに、京都府立医科大学創薬センター長の酒井敏行名誉教授らが開発し、現在世界中で広く使用されている分子標的治療薬である
MEK阻害剤(用語1)トラメチニブの細胞死耐性に、RPS5が関与していることを見出し、そのメカニズムを明らかにしました。この成果を早期に実用化するため、RPS5タンパク質の立体構造に関して、スーパーコンピューター(以下スパコン)を用いた計算機シミュレーションを行うことにより、RPS5タンパク質に結合する薬物候補分子を探索したところ、既に消炎鎮痛薬や抗血小板薬として広く使われており、がん治療薬としても期待されているアスピリンが、RPS5と強力に結合し、またトラメチニブと併用することで、効果的に細胞死を誘導することを明らかにしました。この研究により、
『RPS5によるMEK阻害剤トラメチニブの細胞死耐性メカニズム』が明らかになったとともに、『
がんに効果がある天然由来化合物が結合するタンパク質の同定とその構造解析に基づいた新たな創薬基盤』の開発につながることが期待されます。
1 研究分野の背景
近年、がんの網羅的遺伝子解析技術が発達し、がんの原因となる遺伝子異常が次々と見つかっています。一方で、がん細胞内では、そうした特定の遺伝子異常が直接の原因ではない、タンパク質の「量」や「質」の異常が集積していることが分かってきています。この問題に対し、私たちは、ケモプロテオミクス(用語2)という手法を用いて、これまでがんの増殖を強力に抑える天然植物由来成分が、がん細胞内で結合し、腫瘍抑制に重要となる種々のタンパク質を同定してきました。しかしながら、それらの天然物をそのまま、がんの治療や予防のための薬とするのは難しいという問題がありました。
2 研究内容・成果の要点
今回、私たちはケモプロテオミクスに、スパコンを用いた「計算機シミュレーション」(用語3)に基づくタンパク質-化合物結合力予測を組み合わせることで、トラメチニブの効果を大きく向上させる医薬品を探索しました(図1)。
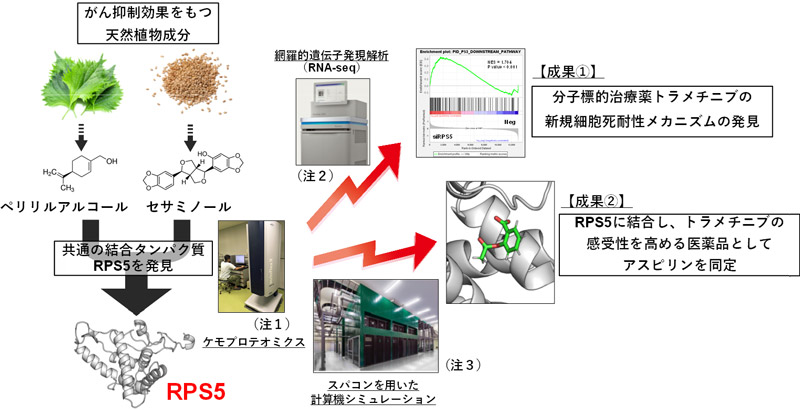
注1:写真は今回解析に用いた、ブルカー社製質量分析計Autoflex Ⅱ
(画像は京都府立医科大学中央研究室での実際の解析風景)
注2:写真は今回解析に用いたイルミナ社製次世代シーケンサーNovaSeq 6000 Sequencing System
(画像はhttps://jp.illumina.com/systems/sequencing-platforms/novaseq.html より転載)
注3:写真は今回解析に用いた、スーパーコンピューター大規模AIクラウド計算システム(ABCI)
(画像は産業技術総合研究所より提供)
図1本研究の概要
異分野融合型横断的研究により、がん抑制天然植物成分の標的同定から、分子標的薬の感受性増強薬の発見とその分子メカニズムの解明へ
<成果①> シソとゴマの成分の結合タンパク質RPS5は、がん抑制遺伝子p53の発現を抑制することで、MEK阻害剤トラメチニブの細胞死耐性に関与する
私たちはこれまで、シソやハーブに含まれるペリリルアルコールとゴマ油に含まれるセサミノールががん抑制作用をもつことを報告してきました。そこで今回、これらの化合物をナノ磁性ビーズに固定化し、がん細胞内のタンパク質と反応させ、質量分析計を用いたケモプロテオミクスにより、両化合物に結合するタンパク質を網羅的に探索したところ、両者共通の結合タンパク質として、RPS5 (ribosomal protein S5)を特定しました(図2)。RPS5は普段はmRNAからタンパク質を翻訳するリボゾームという複合体のなかに存在するタンパク質ですが、公共データベースを用いた解析により、大腸がんや肺がんの予後不良に関与していることが分かりました(図3)。さらに、RPS5の発現を抑制することで、トラメチニブによる細胞死が誘導され、がん細胞の増殖が強く抑制されることを見出しました(図4)。さらに、次世代シーケンサーを用いた網羅的遺伝子発現解析(RNA-seq)により、RPS5の発現を抑制することが、最も重要ながん抑制遺伝子のひとつとされるp53の発現を誘導することが分かりました(図5)。以上の実験結果から、ペリリルアルコールとセサミノールの結合タンパク質RPS5はp53の発現を抑制することで、トラメチニブの細胞死誘導を抑えている可能性が示されました。
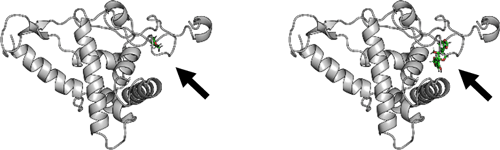
図2 RPS5に結合するがん抑制天然植物由来成分
左:ペリリルアルコール(矢印)とRPS5
右:セサミノール(矢印)とRPS5
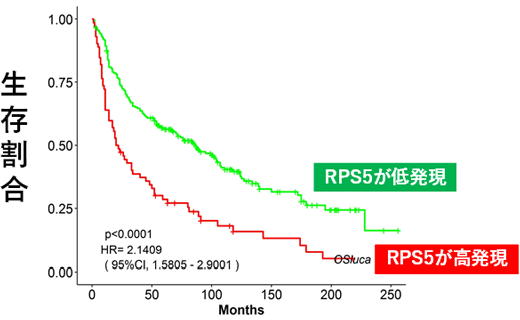
図3 RPS5の高発現は肺がんの予後不良と相関する
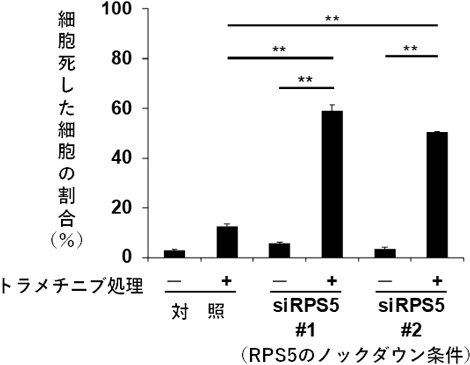
図4 RPS5のノックダウン(発現抑制)により、 トラメチニブは肺がん細胞に対し、細胞死を誘導する
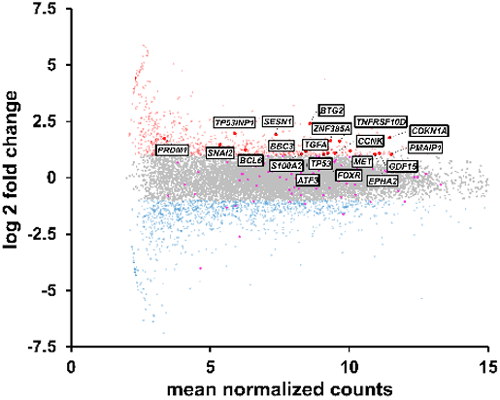
図5 RPS5のノックダウンにより発現上昇したp53関連遺伝子群(四角内がp53関連遺伝子)
<成果②>スパコンを用いたRPS5結合物質スクリーニングにより、アスピリンがRPS5に結合し、トラメチニブとの併用により強い細胞死を誘導する
次に、私たちはペリリルアルコールやセサミノールのように、RPS5に結合する物質を既存の医薬品のなかから探索することにしました。スパコンを用いた計算機シミュレーション(用語3)により、熱力学的に「RPS5に結合しやすい物質」をスクリーニングしたところ、最終的に選別された全765医薬品中、第11位に、消炎鎮痛剤として有名で、がんの治療薬や予防薬としても期待されているアスピリンを見出しました。そこでさらに、スパコンを用いた計算機シミュレーションにより、アスピリンが、イオン性の相互作用により、安定的にRPS5と結合することを示し(図6)、実際、トラメチニブとアスピリンを併用処理することにより、がん細胞の細胞死が誘導され、強い増殖抑制効果を示すことが明らかになりました(図7)。
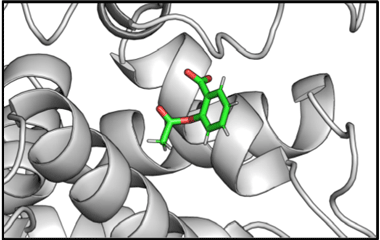
図6 RPS5に安定的に結合するアスピリン(中央の緑と赤の物質がアスピリン)
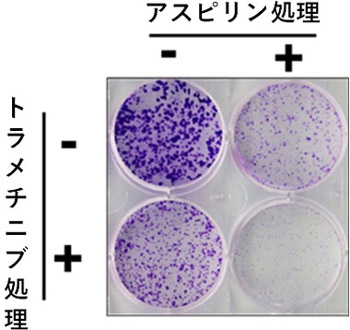
図7 トラメチニブとアスピリンの併用効果
3 今後の展開と社会へのアピールポイント
今回私たちはがん生物学やケミカルバイオロジー、計算科学を駆使した異分野融合型の横断的研究により、トラメチニブの細胞死誘導のボトルネックとなるタンパク質RPS5と、RPS5に強力かつ安定的に結合し、トラメチニブの細胞死誘導を助ける医薬品としてアスピリンを見出すことに成功しました。この私たちの新規がん創薬戦略は、様々ながんへの応用も十分可能であり、将来的に真に実行可能ながんの精密医療や先制医療実現のために、大規模化合物ライブラリーを用いた薬物候補分子探索から、臨床試験につながる、次世代のがん創薬基盤を構築したいと考えています。
本研究は、以下の研究費の支援を受けて行われました。
一般財団法人京都予防医学センターがん研究助成 (30-049)
日本学術振興会 科研費 基盤(A) (19H01079)
日本学術振興会 科研費 基盤(C) (22K10489)
国立研究開発法人日本医療研究開発機構(AMED) 革新的がん医療実用化研究事業(J212001039)