国立研究開発法人 産業技術総合研究所【理事長 石村 和彦】(以下「産総研」という)細胞分子工学研究部門【研究部門長 宮崎 歴】多細胞システム制御研究グループ 舘野 浩章 研究グループ長、箕嶋 文 テクニカルスタッフ(研究当時)、小高 陽樹 研究員は、国立大学法人 筑波大学【学長 永田 恭介】(以下「筑波大」という)医学医療系 生命科学域バイオインフォマティクス分野 尾崎 遼 准教授と共同で、1細胞の糖鎖と遺伝子を同時にプロファイリング(特徴を抽出)する世界初の技術を開発した。
DNAバーコードを導入した糖鎖結合タンパク質(レクチン)を複数用いることで、細胞の目印である糖鎖と、細胞の性質を示す遺伝子を、次世代シーケンサー(DNA解読装置)で1細胞ごとに同時プロファイリングする技術を開発した。本技術は疾患の原因となる希少細胞を標的とした治療薬の開発や、再生医療に用いる細胞の品質管理をはじめさまざまな生命医学研究への貢献が期待される。なお、この技術の詳細は、2021年7月16日に国際学術誌「iScience」に掲載された。
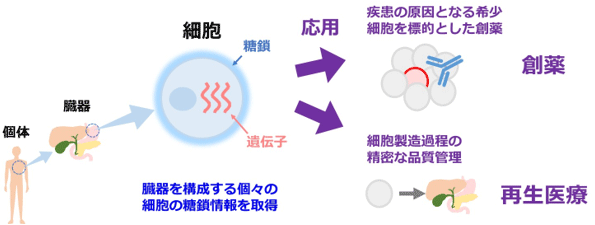
個々の細胞の糖鎖と遺伝子の情報を取得
糖鎖はブドウ糖などの複数の単糖がつながって構成される化合物であり、細胞の表面を覆っている。糖鎖は単糖の種類やつながりなどによりさまざまな種類が存在し、最も多様で複雑な細胞情報をもっている。糖鎖は細胞の種類や性質(分化、癌化など)により形が大きく変化することから細胞の目印として、各種疾患の診断や治療、再生医療に用いる細胞の品質管理などへの応用が進んでいる。
近年、個々の細胞に発現する遺伝子などの情報を網羅的に解析する技術が開発され、がん、免疫、神経、幹細胞などの研究分野で広く活用されている。しかし、従来は細胞集団単位の糖鎖情報しか得られず、個々の細胞表面の糖鎖を解析する方法がなかった。そのため、腫瘍組織中に存在する希少な細胞であるがん幹細胞や、血液中に少数しか存在しない血中循環腫瘍細胞の糖鎖情報を取得することができなかった。
産総研ではこれまで、複数のレクチンの反応パターンから糖鎖の特徴を抽出する糖鎖プロファイリングと呼ばれる技術の開発を進めてきた。数十種のレクチンをスライドグラス上に配置したレクチンマイクロアレイは、生体試料中の糖鎖プロファイルを一括(バルク)解析することができる。これまでレクチンマイクロアレイを用いて幹細胞やがん細胞をはじめさまざまな細胞にある糖鎖の特徴を見いだし、各種の幹細胞品質管理技術やがんなどに対する医薬品候補の開発を進めてきた。しかし細胞集団を構成する個々の細胞の糖鎖情報を取得できないという課題があった。
なお、本研究開発は、国立研究法人 科学技術振興機構の「研究成果最適展開支援プログラム(A-STEP)産学共同(育成型)」、および「戦略的創造研究推進事業(さきがけ)統合1細胞解析のための革新的技術基盤 (2016~2019年度)」、による支援を受けて行ったものである。
細胞に存在する極微量の糖鎖を解析するためには、糖鎖情報を増幅して解析する必要がある。そこで、個々のレクチンに対応した短い塩基配列の目印(DNAバーコード)を修飾、細胞に結合したレクチンのDNAバーコードをポリメラーゼ連鎖反応(PCR)で増幅し、次世代シーケンサーでDNAバーコードの数をプロファイリングすれば、細胞の糖鎖プロファイルを取得できるのではないかと考えた。
生物界に存在するさまざまな糖鎖に反応するレクチン39種を選抜し、それぞれに固有のDNAバーコードを導入したライブラリーを構築した(図1A)。次にこのDNAバーコード標識レクチンライブラリーを細胞集団に反応させ、キャピラリー(毛細管:髪の毛のように細い管)を用いて1つの細胞ごとに分離した。そして光照射することでそれぞれのレクチンからDNAバーコードを切り離し、PCR増幅後、1個の細胞に結合したレクチンの種類と分子数を次世代シーケンサーで間接的に計測することで、1個の細胞の糖鎖プロファイルを取得した。この方法をscGlycan-seq(single cell glycan sequencing)と名付けた。さらに、残存した1細胞からRNAを抽出し、既存の1細胞遺伝子発現解析法scRNA-seq(single cell RNA sequencing)で解析することで、1細胞に発現する糖鎖と遺伝子の同時プロファイリング技術scGR-seq(single cell glycan and RNA sequencing)を開発した(図1B)。
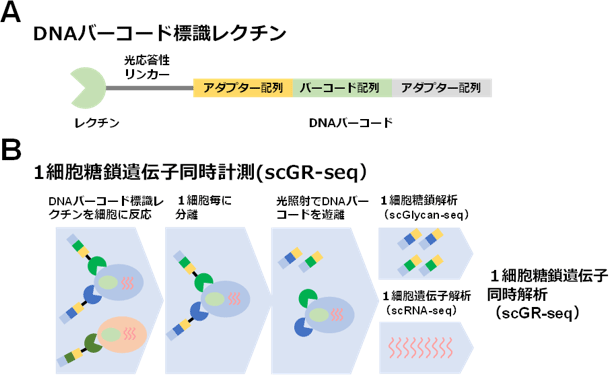
図1 DNAバーコード標識レクチン(A)と1細胞糖鎖RNA同時プロファイリング技術(scGR-seq法)(B)の概要
以前産総研では、iPS細胞に特異的に反応するレクチンの開発に成功していた。そこでまず蛍光標識したiPS細胞特異的レクチンの、iPS細胞と繊維芽細胞への反応性を、蛍光量を測定するフローサイトメトリーで解析した。その結果、iPS細胞特異的レクチンはiPS細胞に結合し、高い蛍光強度を示した(図2A、赤線)。一方、繊維芽細胞には反応せず、蛍光は検出されなかった(図2A、青線)。次にscGlycan-seq法を用いてDNAバーコード標識したiPS細胞特異的レクチンのiPS細胞と繊維芽細胞への反応性を1細胞ごとに調べた。iPS細胞特異的レクチンはフローサイトメトリーの結果と同様に、iPS細胞に対して高い反応性を示した(図2B、赤)。一方、繊維芽細胞には全く反応性を示さなかった(図2B、青)。そのためscGlycan-seq法を用いることで、標準的な方法と同じ結果になることがわかる。さらに主成分分析と呼ばれる統計解析手法を用いて、39種のレクチンの1細胞ごとの反応データを分類したところ、個々の細胞は細胞種(iPS細胞と線維芽細胞)により明確に識別された(図2C、横軸)。さらに同じ細胞種でも、個々の細胞の糖鎖プロファイルの違いがあることがわかった(図2C、縦軸)。一方バルクデータでは、細胞種での糖鎖の違いは確認できたものの、1細胞ごとの糖鎖の違いはわからない(図2C)。すなわちscGlycan-seq法を用いることで、1細胞ごとの糖鎖の違いを解析することができた。
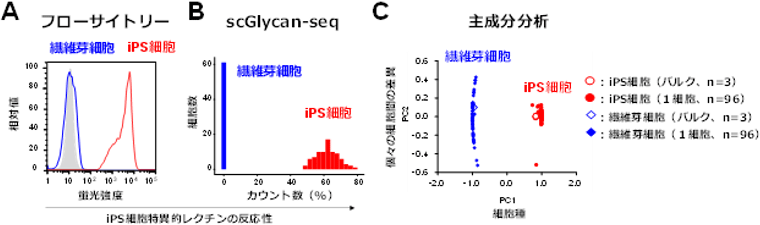
図2 iPS細胞特異的レクチンの反応性比較と主成分分析による細胞の分類
A:フローサイトメトリーによるiPS細胞特異的レクチンの繊維芽細胞とiPS細胞への反応性。
B:scGlycan-seq法によるiPS細胞特異的レクチンの繊維芽細胞とiPS細胞への反応性。
C:主成分分析による39種のレクチンの反応性による細胞の分類。
次に1細胞の糖鎖と遺伝子発現を同時プロファイリングするscGR-seq法を用いて、ヒトiPS細胞とヒトiPS細胞由来神経前駆細胞を解析した。得られたデータをUMAP(Uniform Manifold Approximation and Projection for Dimension Reduction)と呼ばれる統計解析手法で解析した。その結果、いずれか一方の細胞情報(遺伝子発現もしくは糖鎖)だけでは2種の細胞種(ヒトiPS細胞と神経前駆細胞)を完全には識別できなかった(図3A、B)。一方、糖鎖と遺伝子発現両方の細胞情報を用いることで、2つの細胞種を正確に識別できた(図3C)。
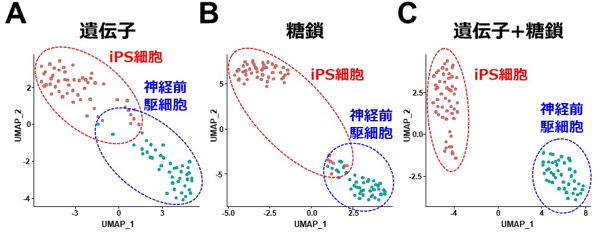
図3 iPS細胞とiPS細胞由来神経前駆細胞の分類
RNA(A)と糖鎖(B)、およびRNAと糖鎖の統合データ(C)に基づく細胞の分類。
UMAP_1、UMAP_2:各データセットの主成分を2次元に次元圧縮した際の直交成分。
最後に、ヒトiPS細胞とヒトiPS細胞由来神経前駆細胞の1細胞に発現する糖鎖と遺伝子の相関解析を行った。その結果、ヒトiPS細胞特異的レクチンの反応性は、多能性マーカー遺伝子(POU5F1)の発現と最も高い相関性を示すことがわかった。さらに神経前駆細胞の分化に関与する遺伝子群と相関を示す新たな糖鎖マーカー候補を同定した。scGR-seq法を用いることで、細胞集団を構成する個々の細胞の遺伝子と糖鎖の両方の情報を取得できることがわかった。
今回開発した1細胞糖鎖解析技術(scGlycan-seq、scGR-seq)を研究用キットとして実用化を進める。また開発した技術を用いて、個体、臓器を構成する個々の細胞の糖鎖をプロファイリングすることで、臓器形成やがん微少環境などにおいて未解明であった糖鎖の役割を解明する。さらに、腫瘍組織、オルガノイド、血中循環腫瘍細胞、ヒトiPS細胞由来の分化細胞などをプロファイリングすることで、新たな医薬品の開発や、再生医療用細胞の精密な品質管理技術の開発へと展開する。