名古屋大学大学院医学系研究科・高等研究院の財津 桂 准教授、川上 大輔 大学院生、国立研究開発法人 産業技術総合研究所 地質情報研究部門の井口 亮 主任研究員らの研究グループは、マウス脳微小透析法(脳マイクロダイアリシス法)1と探針エレクトロスプレーイオン化タンデム質量分析(PESI/MS/MS)2を組み合わせ、自由行動下マウスの神経伝達物質3の濃度変化を1分ごとに観測可能な技術を開発しました。また、単一マウスの時系列データ4にベイズ統計モデリングによる状態空間モデル5を適用し、1匹のマウスから神経伝達物質の挙動を解析できることを明らかにしました。
研究グループが2016年に開発したPESI/MS/MSは、前処理操作が不要で、必要試料量を数µLまで減らすことが可能です。一方、脳内神経伝達物質の古典的回収法であるマイクロダイアリシス法は、脳内に埋め込んだ透析膜に灌流液(臓器の洗浄などに使用される液体)を低流速で流し、一定時間ごとに灌流液を回収して神経伝達物質の濃度変化を観察する手法です。今回、研究グループはマイクロダイアリシス法にPESI/MS/MSを組み合わせ、1分ごとに回収した灌流液を分析することで、神経伝達物質であるグルタミン酸とγ-アミノ酪酸(GABA)の脳内濃度変化を1分ごとに観測できる技術を開発しました。本技術の実用性を評価するため、カリウムイオン誘導脱分極6の前後でマウス線条体7のグルタミン酸およびGABAの挙動を観察しました。単一マウスから得られた時系列データに対して、ベイズ統計モデリングを用いた状態空間モデルを適用した結果、従来の統計解析手法を用いずに、たった1匹のマウスからでも脳内神経伝達物質の挙動を解析できることが明らかとなりました。
今後、本手法をアルツハイマー病モデルマウスやパーキンソン病モデルマウスなどに適用すれば、各病態における脳内神経伝達物質の挙動をより詳細に解析することができ、新たな病態機序の解明や治療薬の応答性評価などに繋がることが強く期待されます。
本研究成果は名古屋大学研究強化促進事業 若手新分野創成研究ユニット・フロンティア(in vivo リアルタイム・オミクス研究室、代表研究者:財津 桂)および国立研究開発法人 産業技術総合研究所の共同研究に基づくものであり、令和3年6月30日付で国際分析化学誌 「Talanta」 オンライン版に掲載されます。
なお、本研究は日本学術振興会 科学研究費補助金 基盤研究(S)「新生児脳におけるニューロン新生とその病態:先端分析技術による統合的理解」(代表研究者:澤本和延)および基盤研究(B)「リアルタイム質量分析による生体マウス脳の時空間メタボローム解析法の開発と実証評価」(代表研究者:財津桂)の支援を受けて実施しました。
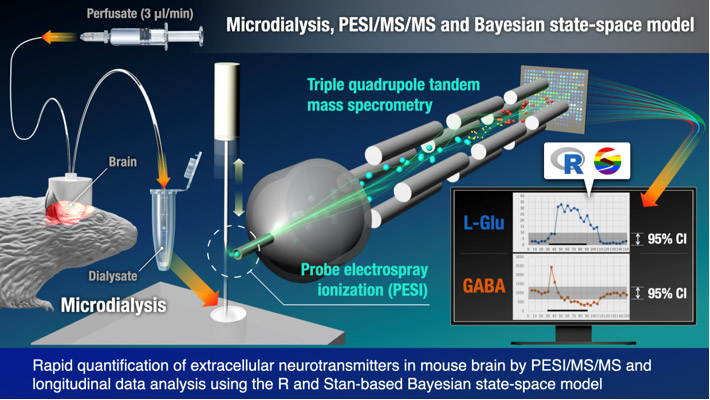
神経伝達物質は神経細胞間の情報伝達を担っており、興奮性のグルタミン酸や抑制性のγ-アミノ酪酸(GABA)が代表例として知られています。脳内では興奮と抑制神経伝達を巧みに調節することで、記憶・学習などの高次脳機能を維持しており、グルタミン酸やGABAなどの神経伝達物質の挙動を観察することは脳病態の解明においても重要です。
マウス脳内の神経伝達物質の挙動を観察する古典的な手法として、脳内に微小透析膜を外科的に埋め込み、神経伝達物質を回収する微小透析法(マイクロダイアリシス法)が知られています。マイクロダイアリシス法では脳内に埋め込んだ微小透析膜の内側に入ってきた神経伝達物質を、外部から灌流液(かんりゅうえき)を数μL/minの低流速で流し込んで回収します。回収した灌流液内の神経伝達物質の測定には、従来、液体クロマトグラフィーや液体クロマトグラフィー質量分析8などが用いられてきましたが、測定に必要な試料量を確保するために、15~20分間、灌流液を集めておく必要がありました。つまり、上記の分析手法を用いると、脳内の神経伝達物質の挙動を15~20分間隔でしか観察できないという制約に繋がっていました。また、質量分析を行うためには灌流液の脱塩処理に時間を要し、操作が煩雑になるという問題点もありました。
一方、これまでにマイクロダイアリシス法を用いて脳内の神経伝達物質の挙動を統計的に解析するためには、複数匹のマウスを用いて実験を行い、それらのマウスの各観測時点における神経伝達物質の濃度を平均化して、時点間のデータについて統計解析(有意差検定)9を行うことが一般的でした。しかし本来、単一のマウスからマイクロダイアリシス法で得られた神経伝達物質の濃度変化は「時系列データ」であり、前後のデータ間には自己相関10がみられます。よって、複数のマウスから得られた時系列データを平均化してしまうと、各マウスの時系列データの傾向が打ち消されてしまうため、より適切な解析手法を構築する必要がありました。
財津准教授らの研究グループは2016年に探針エレクトロスプレーイオン化タンデム質量分析(PESI/MS/MS)(図1)を開発し、これまでに脳微小領域の直接分析や、微量試料の分析を達成してきました。(K. Zaitsu* et al., Analytical Chemistry 2016; Y. Hayashi, K. Zaitsu* et al., Analytica Chimica Acta 2017; K. Zaitsu* et al. Analytical Chemistry 2018; K. Zaitsu* et al. Analytical Chemistry 2020; K. Hisatsune, K. Zaitsu* et al. ACS Omega 2020.) 本手法は極細針を対象成分のサンプリングとイオン化に用いるため、前処理が不要で、わずか数μLの試料量でも分析が可能です。
そこで、マイクロダイアリシス法で得られた灌流液をPESI/MS/MSで分析できるか検討しました。灌流液に用いる人工脳脊髄液(aCSF)にグルタミン酸およびGABAを添加し、PESI/MS/MSで分析を行いました。条件検討の結果、図2に示すような操作フローに従って、定量分析法を構築しました(図2)。
1検体当たりの分析時間は僅か30秒であり、検量線はグルタミン酸、GABAのいずれも良好な直線性を示しました。また、日内および日間における定量精度・再現性が高いことも示されました。特に、本手法ではaCSFを、たった3µL使用するだけでグルタミン酸とGABAの濃度を迅速に測定できます。これはマイクロダイアリシスの灌流液の流速を仮に3 µL/minに設定した場合、1分ごとに灌流液を回収するだけでよく、脳内のグルタミン酸とGABAの濃度変化を1分ごとに観測できるということを意味します。
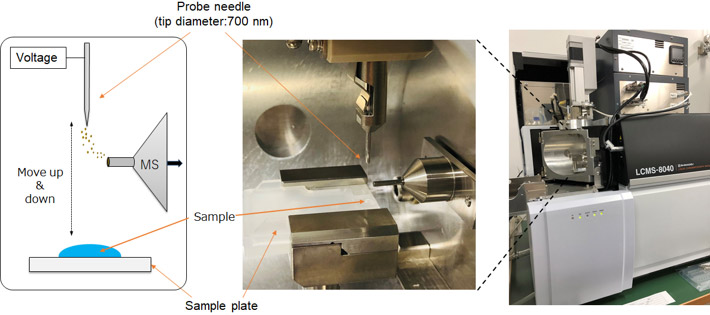
図1 PESI/MS/MSの外観
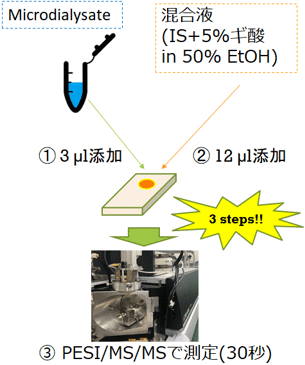
図2 定量分析の操作フロー IS:内部標準物質.
次に、本分析法の実用性を評価しました。マウスの線条体に外科手術によりマイクロダイアリシス法の微小透析膜が付いたプローブを留置し、自由行動下で一定時間aCSF液を灌流させた後、高濃度カリウムイオンを含む灌流液(High-K+液)を灌流させることで、脱分極8を誘導した際のグルタミン酸とGABAの濃度変化を観察しました。ここでは灌流液の流速を3 µL/minとし、5分毎あるいは1分毎に灌流液を回収し、測定を行いました。図3および図4に結果を示します。
図3および図4に示すように、5分ごとに採取したデータ、1分ごとに採取したデータのいずれにおいても、High-K+液に灌流液を切り替えた直後にグルタミン酸の濃度が上昇し、その後、濃度が減少する傾向が観察されました。また、グルタミン酸濃度の上昇よりも少し遅れてGABAの濃度が上昇する傾向も観察されました。
そこで、これらの時系列データをマウスごとに解析するために、ベイズ統計モデリングによる状態空間モデルを応用しました。ここでは、aCSF液を灌流した際の定常状態の濃度(図3では0-25分、図4では0-9分の値)を用いて状態空間モデルより95%信用区間を算出しました。この95%信用区間は図3および図4に青色の帯でそれぞれ示しています。
図3に示す5分ごとの時系列データでは、High-K+液の灌流による脱分極の結果、グルタミン酸およびGABAは95%信用区間よりも高値を示すことが示されました。しかし、図3a-1に示すように、1匹のマウスではグルタミン酸は65分の時点で95%信用区間より低値を示したのに対し、図3b-1に示す別のもう1匹のマウスでは、95%信用区間より低値を示しませんでした。
一方、図4a-1および図4b-1に示す1分ごとの時系列データでは、2匹のマウスにおいて、グルタミン酸は脱分極によって95%信用区間よりも高値を示したのち、この信用区間よりも低値まで下がることが確認できました。この結果、1分ごとに採取したデータの方が、より詳細に脳内の神経伝達物質の挙動を観察できていることが示されました。
また、図3および図4に示したいずれのマウスにおいても、High-K+液を灌流している間、GABAの濃度は95%信用区間よりも高値を示し続けました。従って、本手法を用いることで線条体におけるグルタミン酸とGABAの取り込み機構の差異を詳細に観察できることも示されました。
以上の結果、本研究では自由行動下のマウス脳内神経伝達物質の挙動をわずか1分ごとに観察する手法の開発に成功しました。また、マイクロダイアリシス法から得られた時系列データにベイズ統計モデリングによる状態空間モデルを初めて適用し、その実用性を示すことにも成功しました。
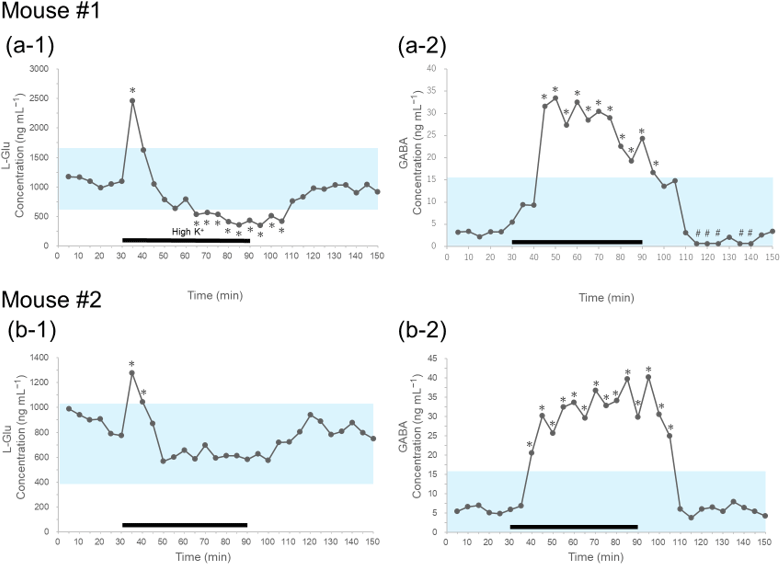
図3 マウス線条体のL-GluとGABAの5分ごとの変化.
5分毎に灌流液を回収し、グルタミン酸(a-1およびb-1)とGABA(a-2およびb-2)の濃度を測定した結果。図中の黒下線部はHigh-K+液を灌流液として流した時間域を示す。*:状態空間モデルより算出した95%信用区間外の値であることを示す。#:検出下限と定量下限の間の範囲にある値を示す。
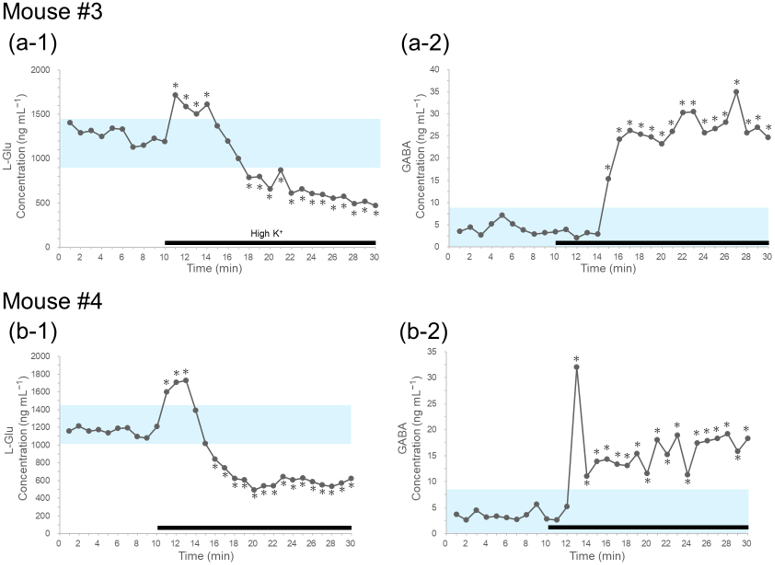
図4 マウス線条体のL-GluとGABAの1分毎の変化.
1分毎に灌流液を回収し、グルタミン酸(a-1およびb-1)とGABA(a-2およびb-2)の濃度を測定した結果。図中の黒下線部はHigh-K+液を灌流液として流した時間域を示す。*:状態空間モデルより算出した95%信用区間外の値であることを示す。
本手法をアルツハイマー型認知症やパーキンソン病をはじめとする病態モデルマウスの解析に応用することで、各病態における神経伝達物質の挙動をより詳細に追うことができるようになると期待されます。特に近年、高い注目を浴びている認知症治療薬の開発における治療効果への応用や薬剤応答性の評価などへの応用が期待されます。
さらに今後、測定対象成分を神経伝達物質以外のものにも拡張することに加え、マイクロダイアリシス法とPESI/MS/MSをオンラインで接続するためのデバイス(現在、特許出願中)を用いることで、脳内生体分子の変化をリアルタイムに測定できる「in vivoリアルタイム脳計測システム」によって、秒単位で脳内分子の変化を観察できる技術の開発を目指します。
掲雑誌名:Talanta
論文タイトル:Rapid quantification of extracellular neurotransmitters in mouse brain by PESI/MS/MS and longitudinal data analysis using the R and Stan-based Bayesian state-space model
著者:Daisuke Kawakami a,b, Mitsuki Tsuchiya a, Tasuku Murata b, Akira Iguchi c, Kei Zaitsu a,d,*
所属:a Department of Legal Medicine & Bioethics, Nagoya University Graduate School of Medicine, 65 Tsurumai-cho, Showa-ku, Nagoya, 466-8550, Japan
b Shimadzu Corporation, 1, Nishinokyo-Kuwabaracho Nakagyo-ku, Kyoto, 604-8511, Japan
c Geological Survey of Japan, National Institute of Advanced Industrial Science and Technology (AIST), Tsukuba, Ibaraki, 305-8567, Japan
d In Vivo Real-time Omics Laboratory, Institute for Advanced Research, Nagoya University, Furo-cho, Chikusa-ku, Nagoya, 464-8601, Japan
DOI: