国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)バイオメディカル研究部門【研究部門長 大西 芳秋】脳遺伝子研究グループ 落石 知世 主任研究員、戸井 基道 研究グループ付、海老原 達彦 研究グループ付、細胞分子機能研究グループ 清末 和之 研究グループ長、は、学校法人 植草学園【理事長 植草 和典】植草学園大学 保健医療学部 角 正美 講師、学校法人 順天堂【理事長 小川 秀興】順天堂大学 医学部 脳神経内科 志村 秀樹 准教授らと、アルツハイマー病(AD)の原因因子の一つであるアミロイドβタンパク質(Aβ)のオリゴマーのみを神経細胞内に発現し、発症初期の病態を示す新規ADモデルマウスを開発した。
ADはAβが凝集し、老人斑となって脳の神経細胞周囲に蓄積することが発症の引き金であると考えられてきた。しかし最近、老人斑ができる以前から神経機能障害が始まり、これを引き起こすのは、少数のAβ分子が重合したAβオリゴマーであることが多数報告されている。産総研はこれまでにAβと緑色蛍光タンパク質のGFP(Green Fluorescent Protein)を融合させると細胞内で3量体前後のオリゴマーを形成することを見出していた。今回、このタンパク質を発現し神経細胞内に蓄積するADモデルマウスを開発した。このマウスは、AD発症初期に見られるオリゴマーの毒性による神経機能障害を示した。このマウスを用いることで、ADの発症原因の解析や予防、初期の段階で病気の進行を抑える創薬候補物質の開発への貢献が期待される。なお、この成果の詳細は、2019年11月22日にScientific Reports誌(電子版、オープンアクセス)に掲載される。
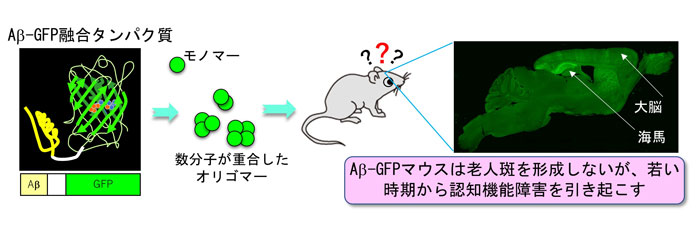 |
| Aβ-GFP融合タンパク質(模式図左)のオリゴマーを発現するADモデルマウス(Aβ-GFPマウス)の開発。脳の海馬や大脳皮質の神経細胞内にAβオリゴマーが強く発現する(右写真)。 |
超高齢社会を背景に、世界的に認知症患者が急速に増加している。それに伴い、介護制度の現状や医療費の問題などが絡み合い、大きな社会問題となっている。認知症の発症や進行を少しでも遅らせることは増大する社会的負担の軽減につながるため、その予防や治療のための創薬研究や早期診断法の開発は喫緊の課題となっている。特にADは認知症の中でも半数以上を占めるにも関わらず、発症メカニズムは未だに解明されておらず、有効な治療法も開発されていない。
ADは神経細胞外でのAβの凝集・蓄積が引き金となって発症すると考えられきた。そこでこの病態を再現するために、これまでAβの前駆体であるアミロイド前駆体タンパク質(APP)を過剰に発現させたさまざまなトランスジェニックマウスが作製された。しかし、APPからはAβ以外のペプチドも過剰発現し、それらによる二次的な作用も考慮しなければならず、ADのモデルとして適切とは言い切れない。一方、最近では、老人斑が蓄積する以前から、Aβオリゴマーが神経細胞内に蓄積し、発症に関与するという説が有力となっている。しかし、これまでのモデルマウスではオリゴマーの作用と神経細胞外の凝集体の作用との区別が困難で、オリゴマーの毒性解析に適したモデルマウスは開発されていなかった。
産総研は、生体メカニズムや疾患の発症メカニズムに関連するさまざまな分子の機能・構造の解明や、疾病の診断に寄与する技術など、創薬・医療基盤技術の開発に取り組んでいる。これまでにAβを生体内で可視化するためAβとGFPを融合させたタンパク質(Aβ-GFP)を開発した。GFPとの融合により、Aβは重合が一定以上進まず、生細胞の細胞質で3量体前後のオリゴマー状態となる(2016年3月16日 産総研プレス発表)。今回、Aβ-GFPをマウス個体に発現させ、生体内でAβオリゴマーの動体や局在部位を直接可視化し、発症初期の神経細胞内の微細な変化を捉え、毒性との因果関係や治療薬の候補物質の効果を解析できる新たなADモデルマウスの開発に取り組んだ。
なお今回の開発は、日本学術振興会 科学研究費補助金(26640023)による支援を受けて行った。
今回開発したADモデルマウスは、Aβ-GFPを発現するトランスジェニックマウス(Aβ-GFPマウス)である。Aβ-GFPマウスは、APPではなく、毒性の強いAβ1-42のみにGFPを融合させたタンパク質を発現するため、APPの過剰発現によって産生されるAβ以外の生理活性ペプチドの作用を考慮する必要がない。また細胞外に分泌されるシグナル配列を持たないので、細胞内だけにAβオリゴマーが蓄積する。脳内では海馬・大脳皮質などの神経細胞に強く発現する。図1Aに示すようにAβ-GFPマウス(左)の神経細胞には、GFPのみを発現した対照マウス(右)と比較してAβ-GFPの小さな粒が無数に見え、細胞内でAβがオリゴマーを形成していることを示している。
ADはAβを主成分とする老人斑の神経細胞周囲への沈着と、過剰にリン酸化されたタウタンパク質が神経細胞内に沈着する神経原線維変化と、脳の萎縮を主な病理学的特徴とする。Aβ-GFPマウスはオリゴマーだけを形成し、細胞外に分泌されないので老人斑は形成せず、脳萎縮も起こらないが、加齢とともにタウタンパク質のリン酸化が亢進した。
記憶や学習に重要な脳の領域“海馬”で、シナプスの可塑性を評価したところ、刺激に応じてシナプス伝達の増強が長く続く長期増強(LTP)が、このモデルマウスでは野生型と比較して有意に低下していた(図1B)。この現象は細胞レベルでの記憶形成に関わる現象として考えられており、機能的に記憶形成に異常があることを示している。また、樹状突起のスパインの数や、一部のシナプス構成タンパク質の量も減少した。これらの現象はAD患者の死後脳から抽出したAβオリゴマーや合成されたオリゴマーを用いたこれまでの報告と同様の結果であり、Aβ-GFPがヒトのAβオリゴマー同様の強い毒性を持つことを示している。
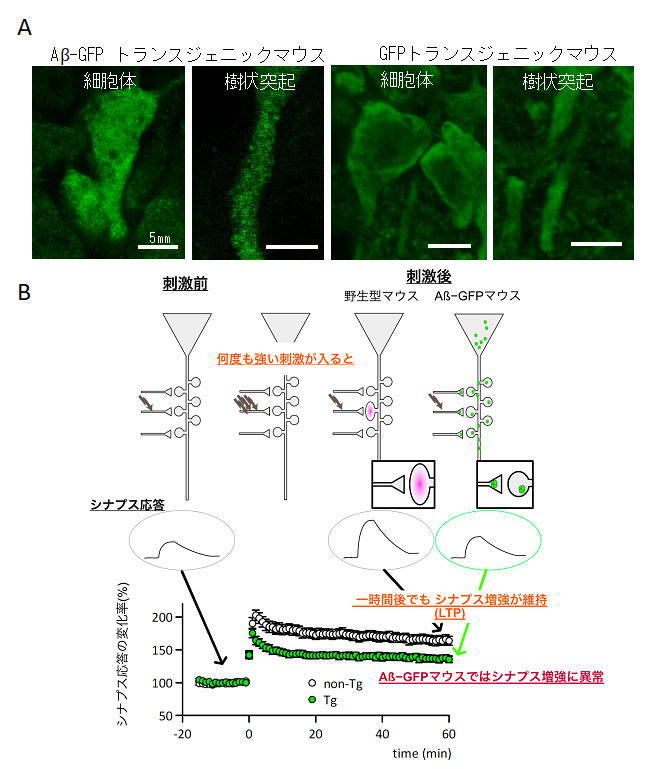 |
| 図1マウスの神経細胞内に発現するAβオリゴマー(A)とLTPの解析による細胞レベルでの記憶・学習能力の検証(B)。 Tgは今回開発したモデルマウス、non-Tgは野生型を示す。 |
今後はAβ-GFPマウスにADの予防薬や治療薬の候補物質を投与して、認知機能の改善に効果のある創薬候補物質の探索を行う。また、認知機能を改善するとされる運動などによる効果をこのマウスで検証し、生体の持つ認知機能向上のメカニズムの解明や、AD予防に関する研究を進める。