国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)人間情報研究部門【研究部門長 佐藤 洋】ニューロリハビリテーション研究グループ 山本 竜也 協力研究員(つくば国際大学 助教)、肥後 範行 研究グループ長、村田 弓 主任研究員と国立研究開発法人 理化学研究所【理事長 松本 紘】(以下「理研」という)生命機能科学研究センター【センター長 西田 栄介】脳コネクトミクスイメージング研究チーム 林 拓也 チームリーダー、合瀬 恭幸 専門技術員は、脳損傷後に新たに形成される神経路を発見した。
モデル動物を用いて、大脳皮質の第一次運動野に永続的な損傷を作成した後、運動機能の回復過程で生じる脳の神経路の変化を調べた。その結果、回復時に、損傷により失われた第一次運動野の機能を代償する損傷周囲領域である「運動前野腹側部」と、滑らかな運動を行うために重要な役割を果たす小脳からの出力を担う「小脳核」との間に新たな神経路が形成されることを発見した。この成果は、脳損傷後に、適切な脳の変化を促すことで機能回復を目指すニューロリハビリテーションの技術開発の鍵となる。
なお、今回の成果は、2019年10月3日(米国東部夏時間)に米国科学誌Journal of Neuroscienceにオンライン掲載された。
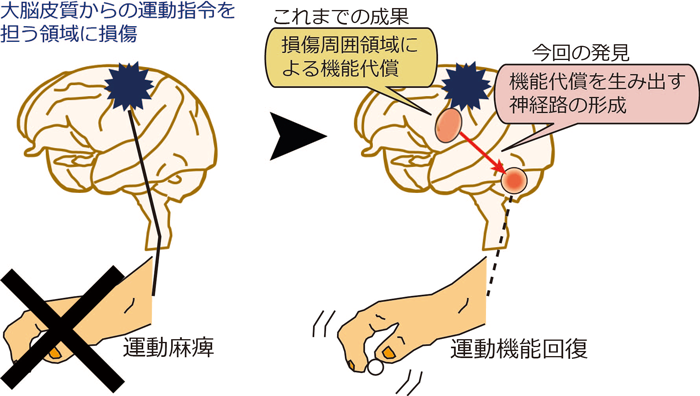 |
| 脳損傷後の運動機能回復に必要な脳の機能的な変化の背景となる神経路の形成を発見 |
脳卒中などで脳に損傷を受けた後、リハビリテーションを受けても後遺症が残ることが多いため、脳の損傷は発症後に介護を必要とする最大の疾病原因の一つである。これは高齢化社会における深刻な問題の一つであり、機能回復を目指すリハビリの高度化が喫緊の課題となっている。
一方、脳の回復メカニズムに基づいた新しいリハビリであるニューロリハビリテーションが注目を集めている。ニューロリハビリテーションは、従来法よりも脳損傷後の機能回復を促進させる可能性を持つと期待されているが、回復をもたらす脳の変化の理解自体が進んでおらず、効果的な回復ができていないという課題がある。効果的なニューロリハビリテーション技術が開発されれば、患者や家族の身体・金銭的負担や医療や介護の社会負担が減り、脳損傷経験者が元気に暮らせる社会の実現につながる。
産総研は、脳損傷モデル動物の開発やモデル動物を用いた脳の回復メカニズムの研究に強みを持ち、その知見を生かしてリハビリ支援技術の研究開発を行ってきた。一方、理研は、脳活動計測技術とその解析法に強みを持っている。両者はこれまでにも共同で脳の機能回復メカニズムに関わる研究を行っており、モデル動物を用いて、手の運動機能を担う脳の領域である第一次運動野に損傷を作製し、リハビリ運動課題を行わせた結果、数ヶ月で手の運動機能が回復した。この時に損傷周囲の「運動前野腹側部」が運動機能を代償することを明らかにし多くの反響を得た(2015年1月7日 産総研・理研共同プレス発表)。その後も両者は脳の機能回復メカニズムの解明に向けて研究を進めてきた。
なお、本研究開発は、独立行政法人 日本学術振興会 科学研究費補助金 基盤研究B(平成28~30年度)と若手研究B(平成30年度~)による支援を受けて行った。
脳機能の回復は、それを支える神経路の変化があって成立する。そのため、第一次運動野が担っていた運動機能を運動前野腹側部が代償することの背景として、リハビリ期間中に新しい神経路が形成された可能性がある。特に運動前野腹側部は、健常時には第一次運動野を介した運動出力を行っているため、第一次運動野の損傷後に運動前野腹側部からの情報を伝えるために、どのような神経路の変化が生じているのかに着目した。
第一次運動野損傷後に運動前野腹側部で生じる神経路の変化を観察するために、ビオチン化デキストランアミン(Biotynilated Dextran Amine、BDA)と呼ばれる解剖学的トレーサーを用いた組織化学的解析を行った。BDAは神経細胞(ニューロン)の細胞体に取り込まれ、軸索内を移動しその終末に至る。今回、BDAを運動前野腹側部に注入し、1ヶ月程度経過して神経細胞の終末に至った時にBDAを含む軸索終末(BDA陽性軸索終末)の分布を観察した。これにより、運動前野腹側部が直接軸索を送って神経路を形成している領域を同定できる(図1左)。
BDA陽性軸索終末の分布を、脳損傷を受けていない個体(健常個体)と、第一次運動野に損傷を作製して手の運動機能が回復した個体(脳損傷個体)とで比較した。健常個体では存在しないが脳損傷個体には存在する神経路は、脳損傷後の機能回復過程で形成されたと考えられる。比較の結果、小脳からの出力を担う小脳核と呼ばれる領域でBDA陽性軸索終末の分布に差が見られ、健常個体の小脳核ではBDA陽性軸索終末が見られなかったのに対し(図1中央)、脳損傷個体の小脳核ではBDA陽性軸索終末が観察された(図1右)。脳損傷個体の小脳核で見られたBDA陽性軸索終末は、脳損傷後の機能回復過程で新たに形成された神経路と考えられる。
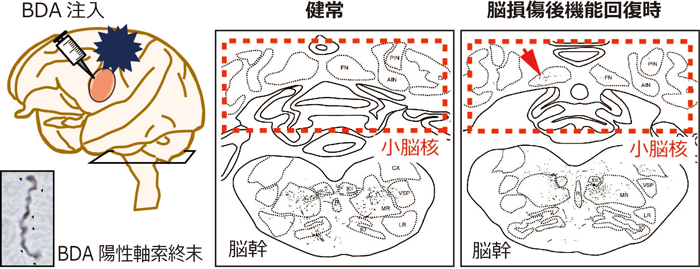 |
図1 (左)BDA注入位置と陽性軸索終末の例、(右)健常個体と脳損傷個体の機能回復時の左図に示した断面でのBDA陽性軸索終末の分布
機能回復時の脳損傷個体にだけ小脳核にBDA陽性軸索終末が観察された。 |
脳損傷個体の小脳核で見られたBDA陽性軸索終末が機能的なシナプスを形成しているのかを検証するために、BDAとシナプスの構成タンパク質の多重蛍光染色を行った。その結果、小脳核の神経細胞にBDA陽性軸索終末が結合する様子が見られ、BDA陽性軸索終末の一部はシナプス構成タンパク質を発現することが明らかになった(図2)。シナプス構成タンパク質はシナプスで情報伝達の役割を果たすため、この結果は、脳損傷後の機能回復過程で運動前野腹側部から小脳核に情報伝達可能なシナプスが形成されたことを示唆する。
 |
図2 小脳核の神経細胞にBDA陽性軸索終末が結合する様子
BDA陽性軸索終末の一部はシナプス構成タンパク質を発現する(矢印:赤と緑が重なり黄色に観察される)。 |
運動前野腹側部から小脳核へ新たな神経路が形成される機能的意義は明らかになっていないが、小脳核から脊髄に至る神経路があることから、運動前野腹側部の情報を伝えるために、新しい代償的な運動出力路(運動前野腹側部→小脳核→脊髄)が形成された可能性がある。
近年になって、脳の神経ネットワークは固定されたものではなく柔軟に変化しうることが分かってきた。そのため、従来のリハビリテーションでは、残された身体機能で日常生活を送る訓練など、機能回復を目指さない訓練も行われていたのに対し、脳卒中などで脳に損傷を受けた後に適切な神経路の変化を促せば機能を回復できるというニューロリハビリテーションの考え方が広まった。損傷を受けた中枢神経組織が再生することはまれで、最近では損傷領域自体の再生よりも機能回復に重要な役割を果たす“代償的神経路の形成”を促すことがニューロリハビリテーションの本質と考えられている。しかし、具体的な神経路の変化はほとんど明らかになっていなかったため、有効なニューロリハビリテーション技術の開発が遅れていた。今回、手の運動機能回復の背景にある神経路の形成を明らかにし、脳損傷後の機能回復を目指すうえで「目標とすべき脳の変化」を示すことができた。この成果は、今後のニューロリハビリテーション技術の開発に向けた貴重な知見となる。
産総研では遺伝子レベルの変化、理研では神経ネットワークの構造変化を解析して、脳損傷後の機能回復に関わる詳細な過程を多角的に解明する。さらに、産総研を中心に、得られた知見を外部機関に展開し、連携による新しいニューロリハビリテーション技術(脳刺激技術やリハビリ促進薬)の開発を目指す。