慶應義塾大学理工学部の藤原慶専任講師、土居信英教授、大学院理工学研究科の光山隼史(博士課程3年)、東北大学材料科学高等研究所の義永那津人准教授、兼産業技術総合研究所 産総研・東北大 数理先端材料モデリングオープンイノベーションラボラトリ(MathAM-OIL)副ラボ長、東京大学大学院総合文化研究科の柳澤実穂准教授の研究グループは、微生物を模倣した人工細胞内において、微生物の細胞分裂面を決めるタンパク質の波を安定的に発生させる条件の解明に成功しました。
本成果の発展により、細胞内における動的なタンパク質配置機構のさらなる理解や、自律的な細胞分裂を行う人工細胞の創出が期待されます。本研究成果の詳細は、科学誌『eLife』のオンライン版に、2019 年7月30 日(英国夏時間)に掲載されます。
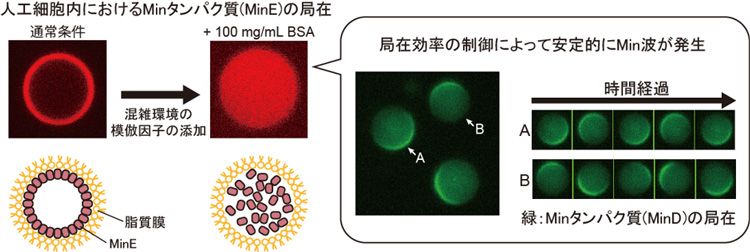
大腸菌に代表されるバクテリアは、Minタンパク質群(MinDとMinE)と呼ばれる要素の協同作用により生じる自発的な往復運動(Min波)によって分裂装置の形成位置を決定しています。近年、このような細胞内において生じる現象に対し、細胞のように脂質膜に覆われた小胞(人工細胞、※1)を生体分子から再度組み立てることによって理解しようという試み(ボトムアップ合成生物学)が盛んになってきています。しかし、これまで人工細胞を構成する脂質の種類によりMin波の発生率が異なるなど、波の発生メカニズムについては実験的にも理論的にも未解明でした。
慶應義塾大学理工学部の藤原慶専任講師と、大学院理工学研究科の光山隼史(博士課程3年)、東北大学材料科学高等研究所兼産業技術総合研究所MathAM-OILの義永那津人准教授、東京大学大学院総合文化研究科の柳澤実穂准教授らは、Minタンパク質2種類を大腸菌から抽出された脂質膜より作製された人工細胞内に封入し、さらに生細胞内に見られるタンパク質による混雑環境(※2)を模倣するような因子(牛血清アルブミンBSAや細胞抽出液)を同時に添加することで、その運動が再現可能であることを見出しました。
本研究では、人工細胞内ではその体積の小ささゆえに、①試験管解析と比較して細胞膜と内部での要素の局在効率が劇的に変化すること、②人工細胞内におけるMin波の発生にはこの局在変化を抑制することが必須であることを実験的に示しました。また、細胞内の混雑環境を模倣するようなタンパク質により、人工細胞でのMin波発生が制御可能となることを明らかにしました。
理論解析からも実験事実が裏付けられるとともに、細胞のような小さな空間ではMin波が発生しないような仕組みが備わっており、要素の局在の制御が重要であることが示されました。
 |
|
図.本研究の成果概要 |
今回の研究によって、タンパク質による協同運動は細胞内という脂質膜に覆われた微小な空間では特殊な条件を満たすことによって初めて生じることが明らかになりました。この成果は、生命システムの理解には細胞のような小さな体積でのみ顕在化する現象を考慮することが重要であることを示します。また、今後さらなる細胞分裂に関わる因子を人工細胞内に導入することで、生細胞と同じように自律的な細胞分裂を行う人工細胞の創出が実現する可能性があります。
本研究は文科省科研費の新学術領域「分子夾雑の生命化学」・「ゆらぎと構造の協奏」、基盤研究B(特設分野研究「構成的システム生物学」)、基盤研究C、慶応工学会の支援を受けて行われました。
Cell-sized confinement controls generation and stability of a protein wave for spatiotemporal regulation in cells
(細胞サイズ閉じ込めは細胞内において時空間的に制御されるタンパク波の発生と安定化をコントロールする)
Shunshi Kohyama, Natsuhiko Yoshinaga*, Miho Yanagisawa, Kei Fujiwara*, Nobuhide Doi
(*:責任著者),eLifeオンライン版, https://doi.org/10.7554/eLife.44591