国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)バイオメディカル研究部門【研究部門長 近江谷 克裕】分子細胞育種研究グループ 千賀 由佳子 研究員、今村 比呂志 協力研究員(現 立命館大学 生命科学部 助教)、構造生理研究グループ 小椋 俊彦 上級主任研究員、同部門 本田 真也 副研究部門長は、産総研で開発した走査電子誘電率顕微鏡(SE-ADM)で、さまざまなサイズ・形状の抗体の凝集体を水溶液中で観察できることを実証した。また、SE-ADMで得られた画像の解析から、抗体の凝集体はフラクタル性を示し、フラクタル次元の算出により凝集体の形成メカニズムの解明が期待できることを明らかにした。
これまで、さまざまな粒子サイズや形態の凝集体を単一の分析法で評価することは困難であった。今回、2014年に開発したSE-ADMを抗体凝集体の観察に適用し、数十ナノメートル(nm)から数百マイクロメートル(μm)以上のサイズの凝集体を電子顕微鏡に匹敵する分解能で乾燥や染色の前処理を行わずに、ありのまま計測できることを実証した。タンパク質科学分野の基礎研究から、抗体医薬品の開発や製造まで、幅広い活用が期待できる。
なお、この成果の詳細は、2019年3月19日(米国東部標準時間)にAnalytical Chemistry (オンライン版)に掲載された。
 |
|
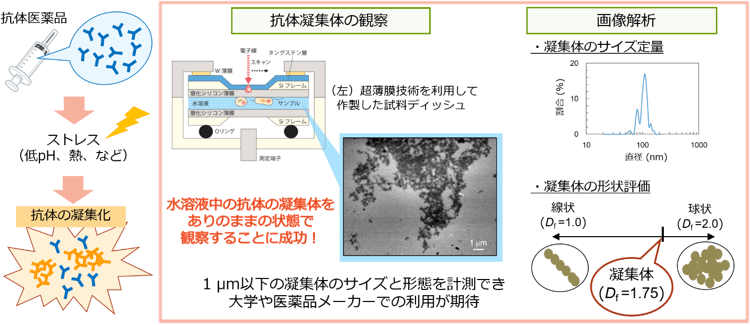
水溶液中の抗体凝集体観察と画像解析 |
がんや自己免疫疾患の治療に広く利用されているバイオ医薬品の品質管理のため、近年、凝集体の分析技術が求められている。中でも抗体医薬品は高濃度のタンパク質溶液として製造されることが多く、生産・保存・輸送などの過程でさまざまな物理的・化学的ストレスに曝されるために凝集体が発生しやすい。特に、精製工程やウイルス不活化工程では、抗体溶液を一定時間、酸性にした後に中和する処理(pHシフト操作)が必須であるが、中和した際に凝集体が発生して徐々に成長していくことが知られている。凝集体は投与時の支障や効能低下のみならず、免疫原性の上昇により患者の免疫反応を惹起し有害事象に導くことが懸念されている。凝集体と免疫原性の因果関係については、2014年に発表されたFDAガイドラインでも警鐘が鳴らされており、凝集体の適切な評価と管理は、有効性と安全性が保証された抗体医薬品の開発、製造にとって不可欠となっている。
抗体をはじめとするタンパク質の凝集体は、ストレス因子などによって大きさや形が変化する。しかし、現状では溶液条件で生成しうる全てのサイズの凝集体を評価できる単一の手法はなく、サイズに応じて分析法が選択されている(図1)。しかし、測定原理などが異なる分析法間では結果を単純に比較できない場合もあり課題となっていた。また、走査型電子顕微鏡(SEM)は数十nm程度から数mm程度の幅広いサイズの試料を観察できるものの、試料を真空中に置く必要があるうえ、試料の乾燥や染色といった前処理や照射する電子線の試料への影響が懸念されている。
このような背景から、水溶液中の抗体などのタンパク質の凝集体をありのままの状態、かつ、凝集初期の微小な凝集体から成長した凝集体までの幅広いサイズ範囲で観察できる分析技術が望まれていた。
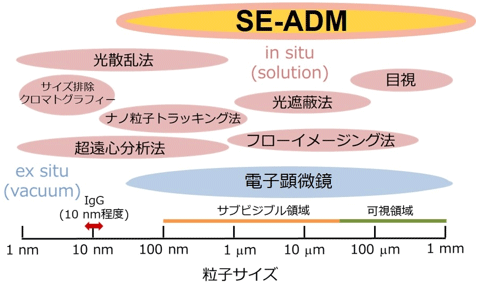 |
図1 各種分析法の適用できる粒子サイズ
主に、溶液条件下で測定する分析法(赤)と真空条件下で測定する分析法(青)がある。 |
産総研では、バイオ医薬品産業への貢献を目指して、pHシフト操作によるヒトモノクローナル抗体の凝集化機構の解明と凝集体の検出技術、除去技術の開発を行ってきたが、抗体の凝集化機構の理解を深めるため、新たな手法や新たな発想での研究開発も推進してきた。また、これらとは別にライフサイエンス分野で利用できる顕微鏡関連技術の開発を進めてきた。今回、産総研がこれまでに開発していたSE-ADM(図1)を用いて抗体などタンパク質の凝集体の成長過程の観察に取り組むことにした。
なお、この研究開発の一部は、国立研究開発法人 日本医療研究開発機構(AMED)の委託事業「次世代治療・診断実現のための創薬基盤技術開発(国際基準に適合した次世代抗体医薬等の製造技術)」(JP17ae0101003)による支援を受けて、産総研が参画する次世代バイオ医薬品製造技術研究組合の活動として行った。また、この研究開発の一部は、独立行政法人 日本学術振興会(JSPS) 科学研究費助成事業(JP15H04365およびJP17H05829)の助成を受けて行った。
産総研が2014年に開発したSE-ADMは、半導体用途で実績のある超薄膜技術を利用して作製した試料ディッシュを、SEMに装着して使用する。SE-ADMは、従来のSEMでは不可欠であった試料の脱水・乾燥といった前処理が不要なので乾燥による試料の変形を回避できる。また、電子線が直接試料に照射しないため、電子線による試料への損傷も少ない。さらに、溶液中の生体試料の観察に一般的に用いられる光学顕微鏡に比べて分解能が高く、光学顕微鏡では細部の構造まで確認できない試料でも高倍率で観察できる。
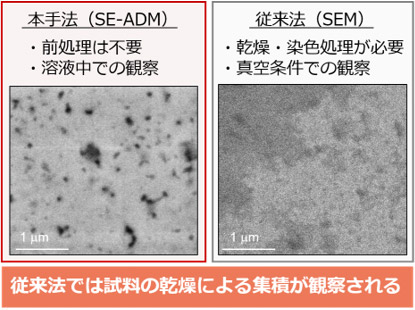
今回、SE-ADMを用いることで、初めてナノメートルオーダーの水溶液中のヒトモノクローナル抗体の凝集体を、そのまま観察することができた(図2左)。酸ストレスを与えたのちに中性条件下に戻すpHシフト操作後の試料をSE-ADMで撮影したところ、さまざまなサイズと形態の凝集体が存在することを示す画像が得られた。一方、比較のために同じくpHシフト操作を施した試料をSEMで観察したところ、乾燥・染色などの前処理によって凝集体同士が集積したと思われる像が認められた(図2右)。
 |
|
図2 今回の手法(SE-ADM)と従来法(SEM)による抗体凝集体の画像 |
次に、pHシフト操作後の試料をSE-ADMで3週間にわたって長期間観察した(図3)。1日経過した試料では、20~70 nmの粒子が大部分を占めていたが、1週間経つと数百~数千nmとなり、3週間後には数十μm以上の凝集体になった。これまでは、抗体の凝集体の分析には試料のサイズに応じて分析法や分析装置を使い分ける必要があった。加えて、装置ごとに試料の分析条件や測定原理が異なることから、装置間のデータを単純に比較することが難しくなっていた。これに対し、SE-ADMを用いれば、凝集体が徐々に成長していく過程や数十nmから数μmまでの幅広い凝集体のサイズ分布を、同一の分析条件・分析装置で網羅的に観察できることが実証できた。また、撮影した画像データからのサイズ計測の信頼性も高く、真度±20 %以下、精度±10 %以下、定量下限50 nm以下で微細構造を定量できた。
また、医薬品メーカーでの品質分析法として用いられているサイズ排除クロマトグラフィー(SEC)や静的/動的光散乱法(SLS/DLS)は、凝集体のサイズ情報しか得られないが、SE-ADMを使用すれば形態情報も解析できる。今回、SE-ADMで撮影した画像から、抗体凝集体の表面が海岸線の地図に似た形をしていることが分かるが、詳しい画像解析を行ったところ、この図形にフラクタル性があることが明らかになった。これまでに、pHシフト操作後24時間までは、抗体がフラクタル性の凝集成長を示すことをSLSとDLSを用いて確認していたが、今回、SLSやDLSでは原理的に計測困難な100 nm以上に成長した24時間以降の凝集体についてもフラクタル性があることが証明できた。
さらに、フラクタル次元が約1.75であることも明らかになった。基礎物理学では凝集体の形成メカニズムと生じた凝集体のフラクタル次元の間に一定の関係があることが知られている。今回の結果は、抗体の25 ℃での凝集化が粒子の拡散の影響が支配的な反応であることを示唆している。また、SLSとDLSから求めていたフラクタル次元のデータともおおむね一致していたことから、抗体の凝集体は、数nmから成長して数μmのサイズに増大するまで、単一のメカニズムで形成・成長している可能性があると考えられる。
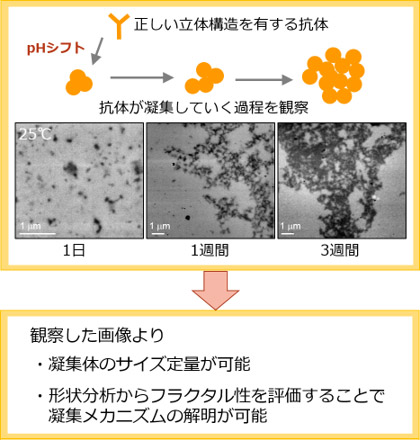 |
図3 時間依存的なヒトモノクローナル抗体の凝集体の観察
試料は、pHシフト操作によって調製した。左から、pHシフト後の凝集体を25 ℃で1日、1週間、3週間保管したものを観察した。 |
今回、SE-ADMが数十nmから数百μmまで幅広いサイズの凝集体の形態やサイズ分布の分析に有用であることが実証された。また、撮影した画像の解析によりフラクタル次元が算出できるので凝集体の形成メカニズム解明に有効と考えられる。今後、実際の医薬品の保管環境を再現し、実保存温度、実保存期間などにおける抗体凝集体の発生成長過程をSE-ADMを用いて長期観察することで、凝集化メカニズムの解明に貢献できる可能性があり、抗体医薬品の凝集体の発生予測や抑制技術開発に波及することが期待される。さらに、SE-ADM画像からフラクタル次元やサイズ分析を行う今回の手法は、抗体に限らず他のタンパク質の凝集化などにも応用できるため、タンパク質科学分野の基礎的な研究への貢献も期待できる。
今後もさまざまな抗体の凝集体について、SE-ADMでの液中観察を実施する。また、さまざまな条件で凝集体を作製し、抗体の凝集体が受ける物理的・化学的ストレスと凝集体のサイズ・形状との関連性を調べ、基礎的知見の集積を目指す。それにより、抗体の凝集化メカニズムの解明に取り組んでいく。