国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】創薬分子プロファイリング研究センター【研究センター長 夏目 徹】機能プロテオミクスチーム 小林 慎 主任研究員は国立大学法人 東京医科歯科大学【学長 吉澤 靖之】 難治疾患研究所 石野 史敏 所長(兼)教授、細井 勇輔 大学院生らと共同で、DNAの変化を伴わない遺伝子発現調節である「X染色体の不活性化」にFtx long non-coding RNAが働くことを明らかにした。
Ftxを欠損させたマウス(Ftxノックアウト(KO)マウス)を用いて、雌KOマウスだけが眼球形成異常を示すこと、さらにX染色体の不活性化の異常を明らかにし、雌でだけで疾患が起こるメカニズムを解明した。この成果は、従来の遺伝学では説明が難しかった性差を示すヒト疾患の病因解明につながると期待される。なお、この研究は科学研究費補助金の支援を受け、成果の詳細は2018年9月20日(英国時間)にNature Communicationsにオンライン版で公開された(https://doi.org/10.1038/s41467-018-06327-6)。
 |
Ftx KO マウスが示す無眼球症
胎仔期に既に眼がない異常が確認できる。 |
エピジェネティクスは、従来の遺伝学では説明できない現象を対象とする新しい研究分野である。また、遺伝学の基礎である「DNAの塩基配列」の変化を伴わない遺伝子発現を調節する仕組みを指す言葉でもある。エピジェネティクスによる遺伝子発現制御は、個体発生のほか、核移植によるクローン動物作製、iPS細胞樹立時のリプログラミングなど、現在注目されているライフサイエンス研究に深く関わっている。また、ガンや生活習慣病を含むさまざまな疾患の原因としても注目を集めている。特に近年では、製薬業界で創薬のターゲットとして、関心を集めるようになってきた。しかし、生理的重要性や制御機構は不明な点も多く、その解明が期待されていた。
産総研と東京医科歯科大学では、エピジェネティクスが対象とする制御や生命現象を理解するために、哺乳類で見られる「X染色体の不活性化」に注目して研究を進めてきた。「X染色体の不活性化」は雌の発生に必須な仕組みだが、そのメカニズムは未解明な点が多く、これまで不活性化の制御機構を理解するため、不活性化制御因子の候補を複数報告してきた(Kobayashi et al, 2013 PlosOne;https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0071222)。
なお、本研究は文部科学省科学研究費補助金の支援を受けて行った。
ヒトを含む哺乳類の性別は性染色体で決まり、雌(XX)は雄(XY)の2倍のX染色体を持っている。雌の2本のX染色体のうち一本では、ほぼ全遺伝子の発現が止まり、染色体全体が不活性化されるため、実際に働くX染色体の数が雄と雌で同じになる。これが「X染色体の不活性化」と呼ばれる現象であり、この仕組みが破綻すると2本のX染色体が活性化し胎仔は死亡するため発生に重要である。
今回、これまでに報告した不活性化制御因子の候補の一つであるFtx long non-coding RNA (lncRNA)の個体での機能を明らかにするため、Ftxを人為的に欠損させたKOマウスを作製した。Ftx KOマウスはこれまで報告された不活性化異常のマウスとは異なり生まれてくるが、目に異常が見られることを発見した(図1)。また図2の家系図が示すように、その異常は雌マウスだけで見られる。一般にメンデルの遺伝の法則では、FtxのようなX染色体上の遺伝子に変異が起きた場合、それが顕性(優性)、潜性(劣性)遺伝に関わらず、雌より雄が明らかな異常を示す。しかしFtx KOマウスでは、その逆で雌にだけ異常が現れ、雄には異常が見られなかった。
 |
|
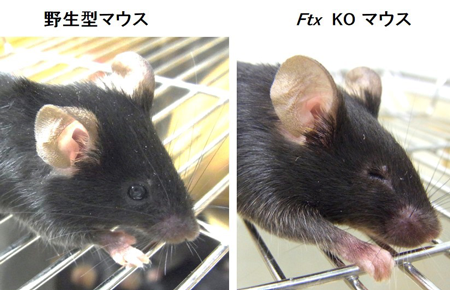
図1 Ftx KOマウスと野生型の比較 |
|
Ftx KOマウスの眼球は野生型よりも小さいか、またはほとんどなく、小(無)眼球症の症状を示す。 |
 |
|
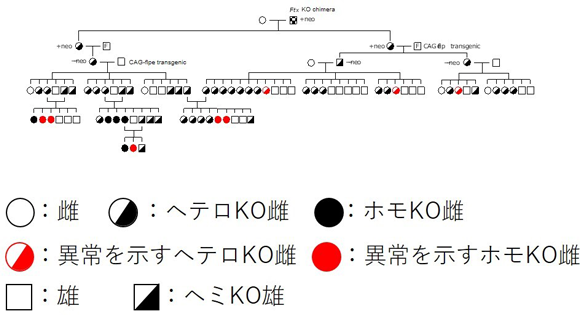
図2 Ftx KOマウスが示す眼の異常の遺伝パターン(家系図) |
|
赤で示した個体は、小(無)眼球の異常を示す。異常は雌(丸印)のみで見られ、雄(四角印)では見られない。また同じFtx欠損を持つ雌個体でも、異常が現れるものと、現れないものがいる。 |
なぜ雌にだけ異常が見られるのか「X染色体の不活性化」に注目して、個体の発生段階を遡り、さまざまな方法を組み合わせて多角的な観点から解析を行った。胎仔期の観察から、異常が現れたKOマウスの眼球は発生の途中で異常を示し、ヒト疾患の小(無)眼球症に酷似することがわかった(概要図)。さらに、RNA-FISHを用いて解析したところ、Ftx KOマウスの細胞核では不活性化されたX染色体から、不活化を逃れた遺伝子のシグナルが検出された(図3)。このような不活性化の異常により発現する遺伝子の数は、個体ごとに異なり、眼の異常の有無と相関があった。さらに不活性化の制御因子として報告のあるXist lncRNAの発現量とも相関があることを突き止めた。これらの結果から、Ftxの欠損により、不活性化制御に異常が起こり、結果として雌でだけ疾患が起こるという、新たな仕組みを解明した。
今回の成果は、ヒト疾患にも応用できると考えられ、従来のメンデルの遺伝の法則では説明できない、X連鎖遺伝で女性の方が重篤になる疾患を、X染色体の不活性化異常で説明できる可能性がある。将来的に、これまで解明が難しかったヒト疾患の病因解明や、エピジェネティクス制御の分子メカニズムの理解につながると期待できる。
 |
|
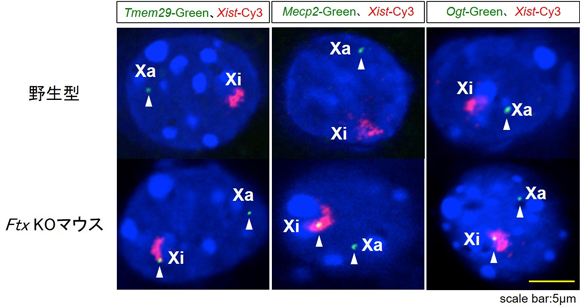
図3 Ftx KOマウスが示すX染色体不活性化の異常 |
|
Ftx KOマウスの細胞核では不活性化されたX染色体(Xi:Xistの赤シグナル)の中から、不活化を逃れた遺伝子のシグナル(Tmem29, Mecp2, Ogt各遺伝子の緑シグナル)が検出された(下段)。野生型ではXiから緑シグナルは検出されない(上段)。 |
今後は、エピジェネティクス制御の分子メカニズム解明、さらにヒト疾患とX染色体不活性化異常との関連について研究を進めていく。
論文情報
論文名:Female mice lacking Ftx lncRNA exhibit impaired X-chromosome inactivation and a microphthalmia-like phenotype(Ftx lncRNAを欠いた雌マウスはX染色体不活性化異常を示し、ヒト小眼球症様の症状を示す。)
著者:細井 勇輔1、相馬 未來1、志浦 寛相1,3,6、佐渡 敬4、蓮輪 英毅5, 7、阿部 訓也3、幸田 尚1,6、石野 史敏1、小林 慎1,2*
所属:1東京医科歯科大学 難治疾患研究所、2産業技術総合研究所 創薬分子プロファイリング研究センター、3理化学研究所 バイオリソースセンター、4近畿大学 農学部、5大阪大学 微生物病研究所、6山梨大学 大学院総合研究部7現、慶應大学 医学部(*は責任著者を示す。)
雑誌名:Nature Communications
DOI:10.1038/s41467-018-06327-6
URL:http://www.nature.com/articles/s41467-018-06327-6
掲載日:日本時間2018年9月20日(木)午後6時(英国時間2018年9月20日(木)午前10時)