国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)生物プロセス研究部門【研究部門長 田村 具博】応用分子微生物学研究グループ 安武 義晃 主任研究員らは、国立研究開発法人 国立国際医療研究センター【理事長 國土 典宏】(以下「NCGM」という)研究所 満屋 裕明 研究所長(NCGM 理事・熊本大学医学部附属病院 総合臨床研究部 特別招聘教授 兼務)、同研究所 難治性ウイルス感染症研究部 レトロウイルス感染症研究室 前田 賢次 室長らと共同で、現在B型肝炎治療に広く用いられている核酸アナログ製剤エンテカビルの作用機構と、薬剤耐性が生じる仕組みを明らかにした。
核酸アナログ製剤のB型肝炎治療薬は、B型肝炎ウイルス(HBV)が持つ逆転写酵素に結合し、その働きをブロックすることでウイルスの増殖を直接的に抑制できる。しかしながら近年、既存の核酸アナログ製剤に対する薬剤耐性が報告され、薬剤耐性HBVを克服するための新しい治療薬の開発が求められている。新しい治療薬開発には既存の薬剤の作用機構を深く理解する必要があり、そのためには薬剤が結合した状態の逆転写酵素の立体構造の情報が不可欠だが、HBV逆転写酵素は非常に不安定なタンパク質で、構造研究は進んでいなかった。そこで今回、ヒト免疫不全ウイルス(エイズウイルス(HIV))の逆転写酵素をHBV逆転写酵素に似るように改変し、エンテカビルが結合できる、いわばHBV型のHIV逆転写酵素を作製した。この改変HIV逆転写酵素にエンテカビルが結合した状態と、DNAの材料であるデオキシグアノシンが結合した状態の立体構造を高分解能で解析した。両者の構造を詳細に比較したところ、逆転写酵素にエンテカビルが結合する仕組みや逆転写酵素がエンテカビルの結合から逃れて薬剤耐性に変わる仕組みが明らかになった。本研究により、薬剤耐性HBVに効果を示す新しい薬剤の開発が期待される。
この研究成果は、2018年1月26日(英国時間)に学術誌Scientific Reportsにオンライン掲載される。
 |
|
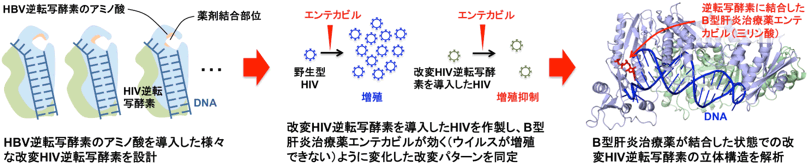
改変HIV逆転写酵素の作製とエンテカビルと結合した状態の立体構造 |
B型肝炎ウイルス(HBV)は全世界で約2億6000万人に持続感染し、慢性肝炎や肝がんを発症することで年間100万人近くが亡くなっていると推定される1。HBVに感染している場合、HBVの遺伝情報(DNA)を人の体内から完全に取り除く方法は未だ確立していない。そのため、肝炎の進行を抑制するために、生涯にわたってウイルス増殖を抑える治療が必要となる。
現在、ウイルスの増殖を直接抑制するB型肝炎治療薬として、エンテカビルなどの核酸アナログ製剤が広く用いられている。核酸アナログ製剤は、ウイルスが自身の遺伝情報を複製して増殖するために必須の逆転写酵素の働きをブロックする強力なB型肝炎治療薬である。しかし近年、逆転写酵素が変化して核酸アナログ製剤が効かない薬剤耐性HBVが報告されている。そのため、薬剤耐性HBVに有効な新しいB型肝炎治療薬や薬剤耐性を獲得させない治療薬の開発が求められている。
産総研では、産業利用や医療分野で有用と考えられるタンパク質の立体構造解析を行い、タンパク質が機能する仕組みの解明や、機能を向上させたり変化させたりする研究開発を進めてきた。NCGM研究所では、これまでHIVを中心とした難治性ウイルス感染症の病理発現機構を解明し、さまざまなエイズ治療薬の研究開発を行ってきた。今回両者は共同で、HIV逆転写酵素をB型肝炎治療薬が結合できるように改変して、薬剤が作用した状態の逆転写酵素の立体構造を解析することで、薬剤の作用機構や薬剤耐性獲得の仕組みを解明し、さらに、それらを新たな治療薬開発に役立てることを目指した研究開発に取り組んだ。
この研究開発は、国立研究開発法人 日本医療研究開発機構(AMED)の「B型肝炎創薬実用化等研究事業」による支援を受けて行った。また実験の一部は、文部科学省の「創薬等支援技術基盤プラットフォーム事業」により、大学共同利用機関法人 高エネルギー加速器研究機構のシンクロトロン放射光施設(フォトンファクトリー)を利用して行った。
薬剤耐性HBVに対応した新たな治療薬の開発には、HBV逆転写酵素に既存の核酸アナログ製剤が作用した状態の立体構造を把握することが重要である。ところが、HBV逆転写酵素は極めて不安定なタンパク質であり、構造を解析できる量と純度のHBV逆転写酵素は未だに生産できていない。一方、HIV逆転写酵素は比較的安定で構造学的研究が世界中で広く行われており、核酸アナログが結合した状態の立体構造解析も進められている。HIV逆転写酵素とHBV逆転写酵素のアミノ酸配列は大きく異なり、全体の構造は全く違ったものと予想されるが、核酸アナログが結合する活性部位では両者に共通したアミノ酸が見つかっており、活性部位の局所構造はある程度似ていると考えられる。そこで、HIV逆転写酵素の活性部位を構成するアミノ酸のうち、HBV逆転写酵素のアミノ酸とは異なる箇所を選定し、それらをHBV逆転写酵素と同じアミノ酸で置換して、HBV逆転写酵素の性質を持つ(B型肝炎治療薬によってブロックされる性質に変化した)HIV逆転写酵素を作製した。
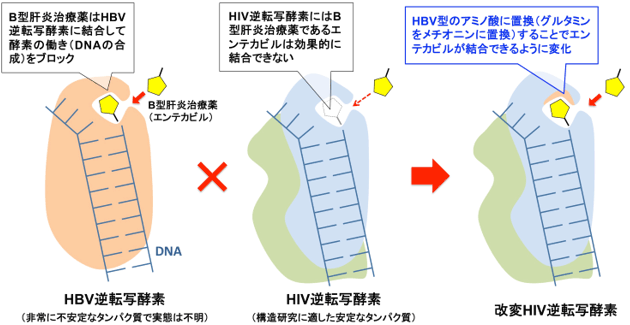
まず、すでに報告されている核酸アナログが結合したHIV逆転写酵素の立体構造から、活性部位を構成するアミノ酸20箇所を調べたところ、12箇所はHIVとHBVの逆転写酵素に共通であったが、残りの8箇所のアミノ酸は異なっていた。そこで、HIV逆転写酵素のこれらの異なるアミノ酸をHBV逆転写酵素のアミノ酸に置換し、いわばHBV逆転写酵素の活性部位を模倣した改変HIV逆転写酵素を5種類作製した。さらに改変逆転写酵素によって増殖できるHIVを作製し、核酸アナログ製剤に対する薬剤感受性を調べた。その結果、活性部位である薬剤結合ポケットの入り口に位置するHIV逆転写酵素のグルタミンをメチオニンに置換するだけで、エンテカビルに対しHIVは高い薬剤感受性を示すようになることが分かった。エンテカビルは、環の外側に疎水性のメチレン基が突き出した特徴的な構造を持つが、それ以外はデオキシグアノシンと完全に同じ構造である。これらのことから、メチレン基と活性部位入り口のメチオニンとの間の疎水性相互作用が、エンテカビルが逆転写酵素の活性部位に侵入し結合するために必要であることが示唆された(図1)。
 |
|
図1 改変HIV逆転写酵素設計の概要 |
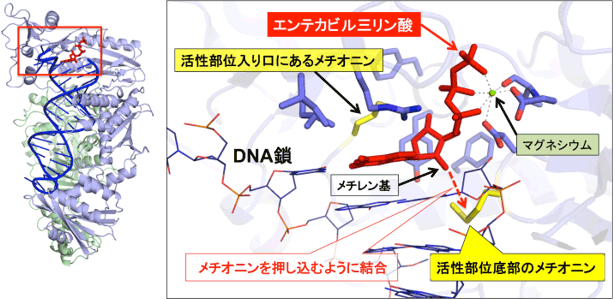
次に、この改変HIV逆転写酵素を結晶化させ、そこにエンテカビル(実際は、体内で代謝された真の作用物質であるエンテカビル三リン酸を使用)を作用させた後、フォトンファクトリーの強力なX線を用いてエンテカビルが逆転写酵素の活性部位に結合した状態の立体構造を解析した(図2)。同時に、この改変HIV逆転写酵素にデオキシグアノシン三リン酸を結合させた状態の立体構造解析も行い、両者を詳細に比較した。その結果、デオキシグアノシンが結合した位置と比べて、エンテカビルはDNAからわずかに離れた位置に結合し、さらに環外に突き出したメチレン基が、活性部位底部のメチオニンを押し込むように移動させ、活性部位の形状を変化させるように結合していた(図2 点線矢印)。HBV逆転写酵素では、この活性部位底部のメチオニンがバリンやイソロイシンに変化するとエンテカビル耐性になることが分かっている。すなわち、エンテカビルのメチレン基と酵素の活性部位底部のメチオニンとの相互作用は、エンテカビルが活性部位で維持されるために重要であり、このメチオニンがより小さなバリンやイソロイシンに置換すると、メチレン基は活性部位底部アミノ酸に接触できない距離となり、結果的にこの疎水性相互作用が失われてエンテカビルは活性部位に安定に結合できなくなると考えられる。
今回得られたエンテカビルが作用した状態の改変HIV逆転写酵素の立体構造情報を利用することにより、逆転写酵素の活性部位によりフィットするような核酸アナログ構造を検討することが可能となり、HBVやエンテカビル耐性HBVに対する新しい治療薬の開発が期待される。
 |
|
図2 エンテカビルが結合した改変HIV逆転写酵素の構造
(左)改変HIV逆転写酵素全体の構造。赤枠はエンテカビルの結合位置。(右)エンテカビル三リン酸が結合した活性部位の詳細な構造。活性部位でエンテカビル三リン酸と相互作用する逆転写酵素のアミノ酸(メチオニン)、マグネシウムイオン、DNA鎖を明示した。
|
今後は、さらにHBV逆転写酵素に近づけた改変HIV逆転写酵素などを作製し、その薬剤感受性の解析や他の核酸アナログ製剤の結合機構の解析を通して、新たなHBV治療薬開発に資する立体構造解析を継続して行っていく。