国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)バイオメディカル研究部門【研究部門長 近江谷 克裕】次世代メディカルデバイス研究グループ 山添 泰宗 主任研究員は、3種類のタンパク質だけからなり、活性酸素を除去できる高機能なマイクロメートルスケールの構造体(タンパク質マイクロマシン)を開発した。
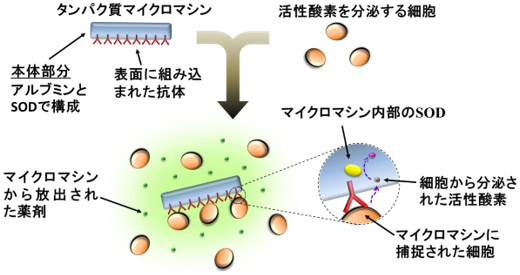
体内で過剰に発生した活性酸素は炎症を引き起こし、さまざまな病気に結びつく。今回開発したタンパク質マイクロマシンの本体部分は、スーパーオキシドディスムターゼ(SOD)(活性酸素を除去するタンパク質)と血清アルブミン(さまざまな薬剤と結合するタンパク質)で構成され、表面には抗体(標的となる細胞を捕捉するタンパク質)が組み込まれている。抗体が活性酸素を分泌する細胞を捕捉し、本体内部のSODが過剰な活性酸素を除去する。また、本体に結合した抗炎症薬の放出により細胞の活性酸素生成を抑制できる。炎症性疾患などの新たな治療法の開発に貢献することが期待される。
なお、この成果の詳細は、2017年 11 月16日(現地時間)に学術誌 Biomaterialsにオンライン掲載される。
 |
|
タンパク質マイクロマシンによる活性酸素の除去 |
血管や臓器の中で働くナノ・マイクロメートルスケールのナノマシンやマイクロマシンを使って、病気の診断、病変部への薬の投与、有害物質の除去などを行う治療法が未来の医療として大きな期待を集めている。このような体内で働くナノ・マイクロマシンは、体に害を及ぼさない安全性の高い素材で作られ、また、その役割を終えた後には体の中で自然に分解されてなくなるのが理想的である。
タンパク質は生体の主要な構成成分で、生体適合性や生分解性が有り、また、結合、触媒、伝達、輸送など多岐に渡る機能を持つので、安全で高機能なナノ・マイクロマシンの素材として有望である。しかし、多くのタンパク質は非常に繊細であり、少しの刺激によって容易にその立体構造が壊れて、機能も失われる。この取り扱いの困難さのために、複数のタンパク質を“部品”として、乾燥状態にも耐えられる強さと高度な機能を備えたナノ・マイクロマシンを組み立てることは困難であった。
産総研では、安全で高度な機能を持つタンパク質を原料として新たな機能性材料を創製する研究を推進している。今回、異なる機能を持つ3種類のタンパク質(血清アルブミン、SOD、抗体)を組み合わせて、過剰な活性酸素を除去できるタンパク質マイクロマシンの開発に取り組んだ。
なお、この開発は、独立行政法人 日本学術振興会 科学研究費助成事業「若手研究(B)(平成 27年度~平成 28年度)」と「基盤研究(C)(平成 29年度~平成 31年度)」による支援を受けて行った。
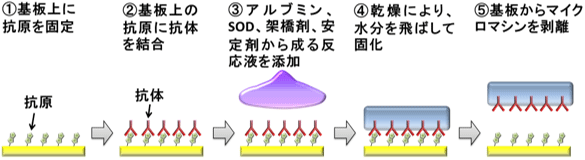
今回開発したタンパク質マイクロマシンの作製方法を図1に示す。まず抗原・抗体反応を利用して基板上に抗体を規則正しく並べ、次に、これをアルブミンなどで構成されるマイクロマシンの本体部分に組み込む。この作製方法は、①作製過程で、タンパク質の構造が破壊されないこと、②過酷な環境(酸性条件下や乾燥状態)でもタンパク質の機能が損なわれないように、マイクロマシン内のタンパク質の安定性を向上させること、③抗体が効率よく抗原と結合できるように、抗体の配向を制御すること、の3点を考慮して開発した。水に不溶性のマイクロマシンを作るために化学処理が必要であるが、タンパク質の構造が破壊されないように、架橋剤を用いた化学処理の反応条件を最適化した。また、反応液に安定剤を加えて、乾燥工程でのタンパク質の構造破壊を防止している。なお、安定剤は全て、マイクロマシン作製後に溶出させて取り除くことができる。また、抗原を固定化した基板を利用して、抗体の抗原と結合する部位が外側に向くように配向制御されているため、効率よく抗原と結合できる。
 |
|
図1 タンパク質マイクロマシンの作製手順 |
マイクロマシン内部のSODは、架橋構造や周囲のアルブミンにより、溶液中に溶解している通常の状態よりも外部刺激(熱やpH変化)に対して安定である。また、抗体は単にマイクロマシンの表面上にのせるような形ではなく、内部に埋まり込むような形で表面に組み込まれているので、抗体分子の抗原結合部分以外の大部分がタンパク質に取り囲まれており、外部刺激(熱、pH変化、乾燥)に対して高い安定性を示す。
作製したタンパク質マイクロマシンは、直径約100 µm の円形の薄いシート状であった。また、共焦点レーザー顕微鏡で膜厚を詳細に解析したところ、中央部で薄く(約170 nm)、外周部で厚い(約740 nm)ことが分かった(図2)。
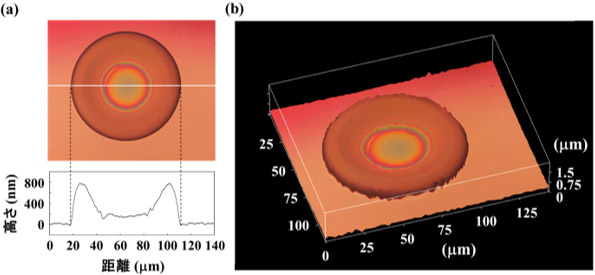 |
図2 タンパク質マイクロマシンの形状
(a) マイクロマシンの断面像 、(b) マイクロマシンの3次元再構築像 |
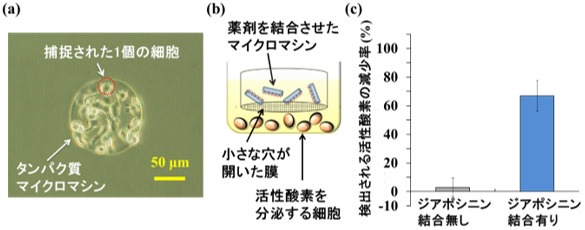
今回開発したタンパク質マイクロマシンを、活性酸素を分泌する細胞と混合したところ、マイクロマシンは、表面に組み込まれている抗体の働きにより良好に細胞を捕捉できることが分かった(図3a)。また、マイクロマシンに捕捉された細胞から周囲に分泌された活性酸素の量を測定したところ、マイクロマシンに捕捉されていないフリーの状態の細胞に比べて、検出される活性酸素の量が70 %減少することが分かった。これはマイクロマシン内部のSODが有効に働き、捕捉した細胞から分泌される活性酸素の大部分を速やかに除去したことを示している。
タンパク質マイクロマシンの本体の主要成分であるアルブミンは、さまざまな薬剤と結合できるので、ジアポシニン(活性酸素を分泌する細胞の活性酸素生成を抑制する効果を持つ抗炎症剤)を結合させたマイクロマシンを作製した。この薬剤結合マイクロマシンを、図3bに示すように、多数の小さな穴が開いた膜を底に貼り付けた容器に入れ、活性酸素を分泌する細胞と、この膜を隔てて共存させた。マイクロマシンや細胞は膜の穴より大きく、互いに接触できないが、マイクロマシンから放出されたジアポシニンは膜の穴より小さいため細胞に到達できる。これらの細胞を回収して、分泌する活性酸素量を測定したところ、マイクロマシンと共存させていない細胞に比べて、活性酸素量が大きく減少していた(図3c)。
一方、ジアポシニンを結合させていないマイクロマシンを用いた場合、検出される活性酸素量に大きな変化は見られなかった。このように、薬剤結合マイクロマシンは、薬剤を周囲に放出することで、捕捉していないものの近くにある細胞についても活性酸素の生成を著しく抑制できることが分かった。
 |
|
図3 タンパク質マイクロマシンの機能の評価
(a) タンパク質マイクロマシンに捕捉された細胞の写真、(b) 薬剤結合マイクロマシンと活性酸素分泌細胞の共存実験、(c) 薬剤結合マイクロマシンを用いた細胞の活性酸素生成の抑制 |
今回、天然素材で安全性の高いタンパク質を使って、高度な機能を備えたマイクロマシンを構築できることが実証されたため、タンパク質を使った安全・安心・高機能な医療用デバイスの開発が進むと期待される。
炎症性サイトカインに結合する抗体などを組み込んで、潰瘍性大腸炎やクローン病などの炎症性疾患の治療に役立つタンパク質マイクロマシンを開発する。また、今回開発した作製手法をバイオセンサーやウェアラブルデバイスなどのデバイス開発にも応用する。