国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)創薬基盤研究部門【研究部門長 織田 雅直】舘野 浩章 主任研究員、平林 淳 首席研究員、幹細胞工学研究グループ 伊藤 弓弦 研究グループ長、小沼 泰子 主任研究員は、国立研究開発法人 国立成育医療研究センター 阿久津 英憲 部長、地方独立行政法人 東京都健康長寿医療センター 豊田 雅士 研究副部長と共同で、ヒト間葉系幹細胞の分化する能力を簡便・迅速に評価する技術を開発した。和光純薬工業株式会社が1年以内に実用化する予定である。
ヒト間葉系幹細胞は自己複製能と分化能を持ち、腫瘍形成の危険性がほとんどないことから、再生医療のための細胞源として注目されている。しかし、ヒト間葉系幹細胞の分化する能力を評価する方法がなく、再生医療に応用する際の課題となっていた。今回開発した技術は、移植前にヒト間葉系幹細胞の治療効果に重要な分化する能力を、ある特定のレクチン(α2-6シアル酸結合性レクチン)を用いて評価できるため、ヒト間葉系幹細胞を用いた再生医療の有効性向上への貢献が期待される。
この成果は、国立研究開発法人 新エネルギー・産業技術総合開発機構(以下「NEDO」という)、国立研究開発法人 日本医療研究開発機構(以下「AMED」という)の委託を受けて行われたものであり、この技術の詳細は2016年4月2日(米国東部時間)に米国科学誌Glycobiologyにオンライン掲載される。
 |
|
ヒト間葉系幹細胞の分化する能力を評価する技術の概要 |
ヒト間葉系幹細胞は骨髄や脂肪などの中胚葉性組織(間葉)に由来する体性幹細胞の一種であり、骨、軟骨、脂肪などの中胚葉性組織に分化する能力や免疫制御能を持つ。そのためヒト間葉系幹細胞は再生医療のための細胞源として期待されており、すでに臓器移植の合併症である移植片対宿主病などさまざまな疾患について臨床試験が行われている。ヒト間葉系幹細胞を用いた再生医療の臨床応用や産業化が進む一方で、ヒト間葉系幹細胞の品質に関する課題が指摘されている。ヒトから採取した間葉系幹細胞は、体外で増殖・分化させた後に、各種疾患の治療のために移植するが、ヒト間葉系幹細胞は不均一な細胞集団であり、その性質はドナー、培養条件、細胞継代数などで変化する。また、ヒト間葉系幹細胞の分化する能力は、治療効果に大きく影響すると考えられるが、これまで評価する方法がなかった。そのため、ヒト間葉系幹細胞の分化する能力を簡便に評価できる技術の開発が求められている。
産総研は、細胞表面を高密度に覆う糖鎖を迅速、高感度に解析する技術であるレクチンマイクロアレイを開発してきた。産総研は幹細胞評価基盤技術研究組合で実施しているAMEDからの委託事業(委託元はNEDO(平成26年度)、AMED(平成27年度~))「再生医療の産業化に向けた細胞製造・加工システムの開発/ヒト多能性幹細胞由来の再生医療製品製造システムの開発(心筋・神経・網膜色素上皮・肝細胞)、ヒト間葉系幹細胞由来の再生医療製品製造システムの開発」に参画している。本事業のうち「ヒト間葉系幹細胞由来の再生医療製品製造システムの開発」プロジェクトは、臨床医療現場のニーズを最大限反映したヒト間葉系幹細胞製品を製造・供給するシステムの実現を目指して研究開発を進めている。今回、レクチンマイクロアレイを用いて、ヒト間葉系幹細胞の分化する能力の評価技術の開発に取り組んだ。
レクチンマイクロアレイを用いて各種のヒト間葉系幹細胞を解析した結果、4種類のα2-6シアル酸結合性レクチン(TJA1、SSA、SNA、rPSL1a)が、分化する能力が高いヒト間葉系幹細胞との反応性が高く、逆に、分化する能力が低い細胞との反応性が低いことが分かった。
ヒト脂肪由来間葉系幹細胞を長期間、継代培養して、継代初期と継代後期の細胞を、分化誘導用の培養液を用いて、骨あるいは脂肪への分化を誘導した後、それぞれアリザリンレッドS(カルシウムに結合する色素)とオイルレッドO(脂肪滴に結合する色素)で染色した結果を図1に示す。骨あるいは脂肪に分化した細胞はいずれも赤色に染色される。継代初期のヒト脂肪由来間葉系幹細胞は、骨あるいは脂肪への分化を誘導した後、赤色に染色されたことから、骨や脂肪に分化する能力を持っていることが分る。一方、継代後期のヒト脂肪由来間葉系幹細胞を骨あるいは脂肪への分化を誘導したところ、いずれも赤色に染色されず、骨や脂肪に分化する能力がないことが分る。
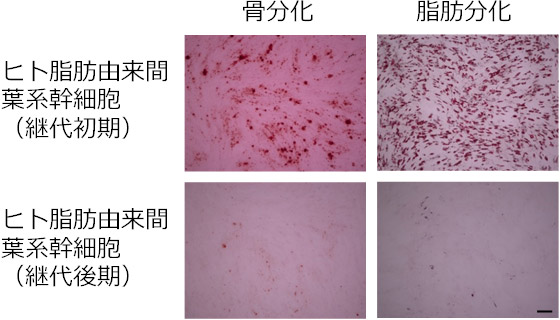 |
図1 継代初期・継代後期のヒト脂肪由来間葉系幹細胞の骨・脂肪分化
骨分化:アリザリンレッドSで染色(骨は赤色で染色)、
脂肪分化:オイルレッドOで染色(脂肪は赤色で染色)。 |
次に、分化する能力がある継代初期のヒト脂肪由来間葉系幹細胞と、分化する能力がない継代後期の細胞をレクチンマイクロアレイで解析したところ、4種類のα2-6シアル酸結合性レクチン(TJA1、SSA、SNA、rPSL1a)が、継代後期と比べ、継代初期の細胞に高い反応性を示した。これら4種類のレクチンを蛍光標識し、フローサイトメーターを用いて、分化する能力がある継代初期のヒト脂肪由来間葉系幹細胞と、分化する能力がない継代後期の細胞に対する反応性を解析した(図2)。4種類のレクチンは、分化する能力がない継代後期のヒト脂肪由来間葉系幹細胞と比べ、継代初期の細胞に高い反応性を示し、結果として継代初期の細胞は強く蛍光染色された。
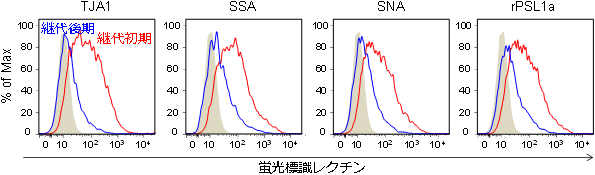 |
図2 継代初期・継代後期のヒト脂肪由来間葉系幹細胞とα2-6シアル酸結合性レクチンの反応性
グレー:コントロール、青線:継代後期、赤線:継代初期
X軸:蛍光強度の相対値、Y軸:相対細胞数 |
細胞に発現するシアル酸の結合様式を液体クロマトグラフィーで調べたところ、分化する能力がある継代初期のヒト脂肪由来間葉系幹細胞ではα2-6シアル酸を検出できたが、分化する能力がない継代後期の細胞ではα2-6シアル酸をほとんど検出することができなかった。また、ヒト骨髄由来間葉系幹細胞や軟骨組織由来軟骨細胞でも、継代後期の細胞と比べて、分化する能力が高い継代初期の細胞は、α2-6シアル酸結合性レクチンとの反応性が高いことが分かった。一方、分化する能力がほとんどないヒト皮膚繊維芽細胞とα2-6シアル酸結合性レクチンは反応しなかった。
これらの結果から、ヒト間葉系幹細胞やヒト軟骨細胞などのヒト体性幹細胞の分化する能力を、α2-6シアル酸結合性レクチンとの反応性で評価できることが分かった。今回開発した技術により、ヒト間葉系幹細胞の分化する能力を簡便に評価できることから、再生医療に用いるヒト間葉系幹細胞の製造過程における品質管理への応用が期待される。
4種のα2-6シアル酸結合性レクチンのうち、大腸菌で調製した組換えタンパク質であるrPSL1aの蛍光標識体は、ヒト間葉系幹細胞の分化する能力を評価するための試薬として1年以内に実用化される予定である。今後は再生医療に用いるさまざまなヒト間葉系幹細胞への適用性を検証し、ヒト間葉系幹細胞を用いた再生医療の実現に貢献していく。