国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)触媒化学融合研究センター【研究センター長 佐藤 一彦】官能基変換チーム 富永 健一 研究チーム長、根本 耕司 研究員らは、安価で入手容易なニッケル化合物を原料とする高活性なニッケル触媒の簡便な調製方法を開発し、この触媒を用いたオレフィン類の効率的なヒドロシアノ化反応(以下「シアノ化反応」という)を実現した。
シアノ化反応は、原料にシアノ基を導入する反応の一つであり、医農薬品や機能性ポリマーの原料として広く用いられているニトリル化合物が得られる。しかし、この反応は空気中では取り扱いの困難な遷移金属錯体触媒が必要であること、ニトリル源(シアノ基源)として毒性の高いシアン化物を大量に用いる必要があることが課題となっていた。今回開発した触媒により、触媒量の削減だけでなく、触媒調製コストの大幅な低下も見込まれる。また、シアン化物に比べて毒性の低いアセトンシアノヒドリンをニトリル源として用いることができるため、低コストでクリーンなニトリル化合物の製造法への貢献が期待される。
なお、この技術の詳細は、平成28年3月24~27日に同志社大学 京田辺キャンパス(京都府京田辺市)で開催される日本化学会第96春季年会で発表される。
 |
|
毒性の高いシアン化物を用いないシアノ化反応 |
ニトリル化合物は、医農薬品や機能性ポリマーの原料として広く用いられており、生活を支える有用な化学品の一つである。従来のニトリル化合物の製造法では、高価なパラジウムやコバルトなどの遷移金属錯体を触媒としてオレフィン類とシアン化物を反応させていた。しかし、これらの触媒は空気や水分と容易に反応して活性を失うため、取り扱いが難しいという問題があった。また、原料として毒性の高いシアン化物を大量に用いるといった問題もあった。近年の化学産業では、グリーン・サステナブル・ケミストリーの理念に基づいて、環境との共生を意識したものづくりが進められている。その中で、触媒の低コスト化だけでなく、毒性の高い化合物を用いない新しいシアノ化反応の開発が強く求められていた。
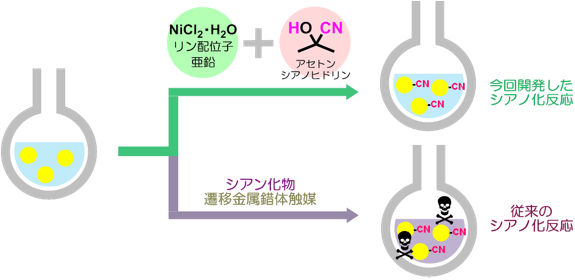
産総研は、グリーン・サステナブル・ケミストリーの推進に貢献する技術開発に取り組んできており、毒性の高い化合物を用いない新しいシアノ化反応の開発はその一つである。シアン化物は毒性の強い化合物であるが、反応性が高く安価なためさまざまな化学品の原料として用いられている。しかし、その毒性の強さのため、シアン化物を利用したプロセスを保有できる企業は限られている。そこで産総研では、低毒性のニトリル源としてアセトンシアノヒドリンに着目し、これを活用した環境調和型のシアノ化反応の開発に着手した。
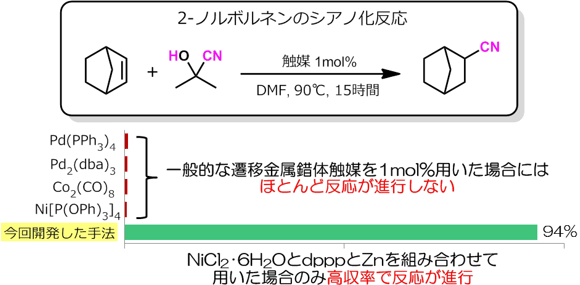
アセトンシアノヒドリンはシアン化物と比べると低毒性であるが、反応性に乏しい。そのため、アセトンシアノヒドリンをニトリル源として用いるためには、遷移金属錯体触媒の使用量を増やす、反応温度を高める、あるいは、特殊な構造をもつリン配位子を添加するといった工夫が必要となり、実用化の観点からは応用が難しいとされてきた。そこで産総研では、安価なニッケル化合物と市販のリン配位子と亜鉛粉末を反応させると、活性の高いニッケル錯体が生じることに着目した。この錯体を反応器の中で調製し、即座に触媒として使用することができれば、空気や水分と容易に反応してしまう遷移金属錯体触媒や特殊なリン配位子を用いずとも、アセトンシアノヒドリンをニトリル源として利用したシアノ化反応が実現できるのではないかと考えた。そこで、塩化ニッケル6水和物(NiCl2・6H2O)を触媒原料とし、リン配位子として1,3-ビス(ジフェニルホスフィノ)プロパン(dppp)をジメチルホルムアミド(DMF)中で混合した溶液に、亜鉛粉末(Zn)、2-ノルボルネンとアセトンシアノヒドリンを加え、90 ℃で15時間反応させたところ、シアノ基が導入された化合物がほぼ定量的に得られた。この反応をモデル反応として、調製した触媒や、既存の遷移金属錯体触媒を1 mol%用いた時の実験結果を図1に示した。既存のパラジウム触媒であるテトラキス(トリフェニルホスフィン)パラジウム(Pd(Ph3)4)やトリス(ジベンジリデンアセトン)ジパラジウム(Pd2(dba)3)、オクタカルボニルジコバルト(Co2(CO)8)、テトラキス(トリフェニルホスファイト)ニッケル(Ni[P(OPh)3]4)を用いた場合にはほとんど反応が進行しないが、今回開発した手法で調製した触媒は極めて高い活性を示すことが分かる。さらに触媒量を0.5 mol%まで減らしても、大きな収率の低下を起こすことなくシアノ化反応が進行した。
 |
|
図1 既存の錯体触媒との性能の比較 |
一般的な遷移金属錯体触媒では、原料の秤量や保管の際に触媒活性が低下することが懸念されるが、本手法では、反応器中で高活性な錯体を調製するため、触媒活性の低下の心配がない。また、遷移金属錯体触媒は反応開始時から徐々に触媒性能の低下が始まるのに対し、本手法では、ニッケル錯体が徐々に生成することによって、高い触媒性能が維持され、高収率でシアノ化反応が進行すると考えられる。
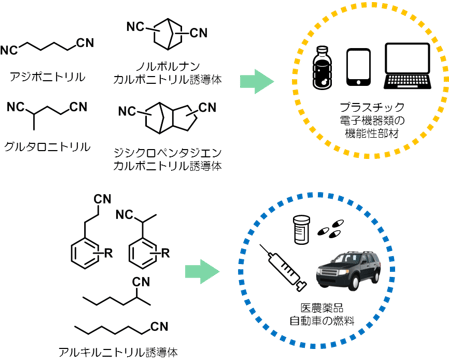
今回開発した手法はさまざまな化合物に適用できる。例えばエステルやアルコールなどの反応性の高い官能基が含まれる化合物やアルキン類も、問題なくニトリル化合物へと変換することができる。また、機能性ポリマーの原料として有用なノルボルナジエンやジシクロペンタジエンに対してもシアノ基を導入できる。さらに、6,6-ナイロンの原料となるアジポニトリルという化合物は、通常は1,3-ブタジエンを原料として三段階の反応で合成されるが、今回開発した手法を用いると一段階で合成できる。
 |
|
図2 今回開発した手法を活用して合成できるニトリル化合物とその将来展望 |
今回開発した手法は、さまざまな有機合成反応への応用が可能と思われる。導入したシアノ基を、反応系中で異なる官能基へさらに変換するなど、応用性・実用性の高い反応へ展開していく予定である。