国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)バイオメディカル研究部門【研究部門長 近江谷 克裕】沼田 倫征 主任研究員、大澤 拓生 元産総研特別研究員らは、細菌などの原核生物が外部から侵入してきたウイルス由来のRNAなどを捕らえて分解するしくみを初めて詳細に解明した。
細菌などの多くの原核生物は、CRISPR-Casシステムと呼ばれる生体防御機構を持ち、ウイルスの感染とその増殖から身を守っている。CRISPR-Casシステムでは、エフェクター複合体がウイルスの核酸(DNAやRNA)を分解する重要な役割を担っている。エフェクター複合体の一種であるCmr複合体は、生体内に侵入してきたウイルスのRNAを認識して分解し、その増殖を抑制する。
今回、標的となるRNAに類似したDNAと結合したCmr複合体の立体構造を解析し、Cmr複合体がウイルスRNAを認識して排除するしくみを明らかにした。Cmr複合体の機能を利用して任意のRNA配列を分解することも可能になると考えられ、今後、新たな遺伝子の発現調節技術の開発が期待される。
本成果は、2015年4月23日(米国東部時間)に、米国の科学誌Molecular Cellに掲載される。
 |
|
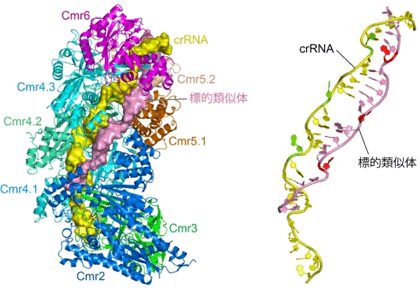
標的核酸を捕捉したCRISPR-Cas Cmr複合体の構造(左)と複合体中におけるcrRNAと標的核酸の形(右) |
細菌などの原核生物において、侵入してきたウイルスのDNAやRNAなどは分解除去されることが知られており、そのしくみも徐々に明らかになってきた。しかし、CRISPR-Casシステムにおいて重要な役割を果たすCmr複合体がウイルスのRNAを除去するしくみは、これまでほとんど分かっていなかった。ウイルスのRNAと結合したCmr複合体の構造を詳しく解析すれば、Cmr複合体が標的のRNAを認識して分解するしくみが明らかになり、ひいては、任意のRNAを分解する分子装置の設計が可能となって、遺伝子の発現を人為的に操作する新たな技術の開発にもつながると期待される。
産総研では、ウイルスRNAを特異的に分解するCmr複合体の機能と構造の研究を行っている。これまでに、Cmr複合体を構成する個々のタンパク質サブユニット群の機能と構造の解析を進めてきた。しかしながら、サブユニットの解析だけでは、Cmr複合体がウイルスRNAを認識して除去する詳しいしくみは理解できなかった。今回、標的の核酸と結合したCmr複合体の立体的な構造解析と構造に基づいた生化学的実験によって、Cmr複合体が形成されるしくみやウイルスRNAを分解する機構の解明を進めた。
本研究は、文部科学省の科学研究費補助金 新学術領域研究「構造細胞生物学」の助成を受けて行った。なお、X線回折データは、大学共同利用機関法人 高エネルギー加速器研究機構のフォトンファクトリー(ビームラインBL17A)を利用して測定した。
ウイルスの感染から身を守るために、多くの原核生物はCRISPR-Casシステムという生体防御機構を持つ。初めてウイルスに感染すると、ウイルス核酸の一部をゲノム上のCRISPR領域に組み込み、ウイルスの感染履歴を自身のゲノムに記録する。同じウイルスに再感染すると、CRISPR領域からcrRNAという小さなRNA分子が合成され、Casタンパク質と会合してエフェクター複合体を形成する。crRNAはウイルス核酸と相補的な配列を持つので、エフェクター複合体はウイルス核酸(DNAやRNA)を認識して除去できる。Cmr複合体は、エフェクター複合体の一種であり、6種類のCasタンパク質(Cmr1~Cmr6)とcrRNAからなる。crRNAは5’側に8ヌクレオチドから成るタグ配列、続いて31ヌクレオチドから成るガイド配列をもち、Cmr複合体はガイド配列と相補的なRNAを捕えて分解する。
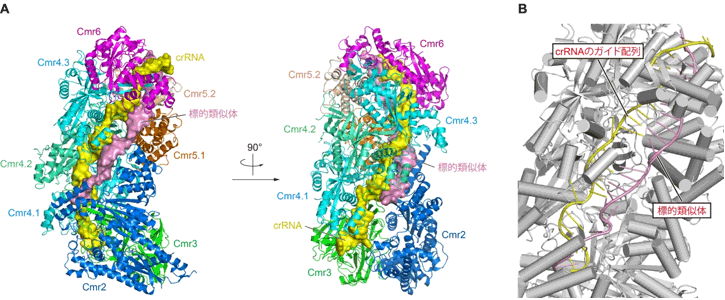
標的のRNAはCmr複合体によって分解されてしまうため、標的RNAと結合したCmr複合体の結晶構造を解析することは難しい。今回、認識されるが分解されない標的類似体(標的のRNAと同じヌクレオチド配列をもったDNA)を用いて、それと結合したCmr複合体の結晶構造を解析した。その結果、Cmrタンパク質サブユニット群がらせん状に会合していること、そして、らせん状の溝が形成され、そこにcrRNAが配置されていることが分かった。標的類似体は、この溝に沿ってcrRNAのガイド配列に相補的に捕捉されていた(図1)。
 |
|
図1 標的核酸と結合したCmr複合体の構造 |
(A) Cmr複合体の全体構造。右図は左図を90°回転させたもの。
(B) 標的類似体(桃色)はcrRNA(黄色)のガイド配列によって相補的に認識されている。
|
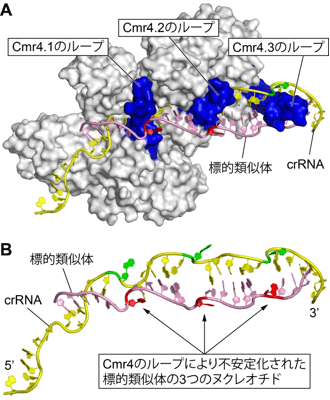
crRNAのガイド領域と標的類似体は2本鎖を形成していたが、核酸の一般的な2重らせん構造とは異なり、ほどけたリボン状であった。これは、サブユニットの一つ、Cmr4が持つ特徴的なループ領域が、6塩基対ごとに2本鎖の間に割って入り、塩基対の形成を周期的に阻害しているためである(図2A)。Cmr複合体は3分子のCmr4サブユニットを含むため、ガイド領域と標的の2本鎖は3カ所で塩基対の形成が阻害され、標的RNAの構造が大きく歪んで不安定化していた(図2B)。生化学的な実験から、Cmr複合体は6ヌクレオチド周期でこれら3カ所を切断することが分かった。
 |
|
図2 Cmr複合体に捕捉された標的核酸の構造 |
(A) Cmr4が持つ特徴的なループ(青)が、crRNAと標的類似体の2本鎖の間に入り、周期的に塩基対の形成を阻害している。
(B) crRNAと標的類似体の構造。標的類似体の3つのヌクレオチド(赤)の構造が歪んでいる。 |
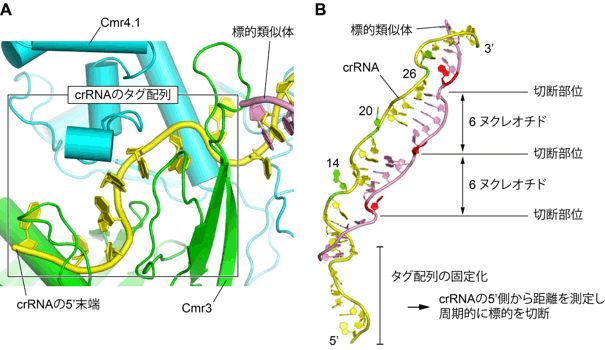
crRNAの5’側に存在するタグ配列はCmr3サブユニットに認識され、複合体中で固定化されていた(図3A)。このため、Cmr複合体はcrRNAの5’側から数えて一定距離にある14番目、20番目、26番目の塩基対の形成を阻害し、標的RNAを6ヌクレオチド周期で切断する(図3B)。crRNAのタグ配列はヌクレオチドの配列に依存してCmr3によって認識されていたが、ガイド配列とCmrタンパク質との間の結合は、ガイド部分の配列に依存しないことが分かった。したがって、Cmr複合体は、任意のガイド配列をもったcrRNAと結合でき、さまざまな標的RNAを捕捉し分解することができる。
 |
|
図3 標的RNAを周期的に切断するしくみ |
(A) crRNAのタグ配列はCmr複合体中で固定化されている。
(B) Cmr複合体は、固定化されたタグ配列から一定の距離にある標的RNAを周期的に切断する。 |
Cmr複合体は、さまざまなガイド配列を持ったcrRNAを取り込み、それらと相補的な標的RNAを分解できるため、さまざまな標的に対応できる。これにより、原核生物は、臨機応変に標的RNAを分解するという機構を獲得している。この複合体が働くしくみを解明したことより、部位特異的にRNAを切断する新たな分子装置の設計が可能となり、遺伝子の発現を人為的に操作する新たな技術の開発へつながることが期待される。
任意のRNAを分解し、遺伝子の発現を人為的に制御するには、Cmr複合体による化学反応機構を詳細に解き明かすことが不可欠である。今後、さらなる構造解析と機能解析から、RNAを切断する化学反応機構を詳細に解明していく予定である。