独立行政法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)電子光技術研究部門【研究部門長 原市 聡】光センシンググループ 藤巻 真 研究グループ長と、フレキシブルエレクトロニクス研究センター【研究センター長 鎌田 俊英】先進機能表面プロセスチーム 野村 健一 研究員、福田 伸子 主任研究員は、検出対象のバイオ物質に付着させた蛍光標識からの発光信号を表面プラズモン共鳴励起蛍光増強(SPRF)機能によって強めて、対象バイオ物質の高感度検出ができるV字型の断面を持つマイクロ流路型センサー(V溝バイオセンサー)チップを開発した。
今回、マイクロ流路の断面をV字型にすることによってSPRF機能の発現に必要な光学プリズムと表面プラズモン共鳴(SPR)励起層を、流路と一体的に構成した。さらに、センサーの光学系を一直線上に配置して、SPRFの高感度性とマイクロ流路の簡易操作性とを併せ持つバイオセンサーシステムを実現した。体内の極微量の疾患由来物質(バイオマーカー)やウイルスなどの定量検出が数µL程度の極微量試料で行え、臨床現場でのより正確な診断に加え、日常の健康管理にも役立つバイオセンサーシステムとして貢献が期待される。
本研究の一部は、独立行政法人 新エネルギー・産業技術総合開発機構(NEDO)の委託事業により得られたものである。
なお、この成果は、2013年12月12日(英国時間)発行の英国科学雑誌Nature Communicationsで公開される。
 |
|
V溝バイオセンサーチップ(左)と市販装置をベースに試作したV溝バイオセンサー用蛍光検出装置(右) |
近年、さまざまな疾患に起因して体内に発生するバイオマーカーが特定されてきており、糖尿病のような生活習慣病やガンなどの早期発見が可能となってきた。さらに、これらのバイオマーカーを検出することで、まだ病気ではないが病気になりつつある状態、つまり未病状態が検知できることも分かってきており、人を病気にさせない技術として注目を集めている。また、感染症でも、感染初期の極微量の菌やウイルスを迅速に高感度で検出できるようになれば、治療の初動を早めることで早期回復が期待できるとともに、感染拡大の阻止にも繋がる。
これらを実現する鍵となる技術が、超高感度バイオセンサー技術である。既にいくつものセンサー技術が実用化されているが、簡易検査では十分な感度や定量性が得られないといった問題がある。一方、高感度な検出手法では、操作が煩雑でその場での迅速な判定は難しい。現状では、未病状態や感染初期を正確にその場診断できる技術はなく、その実現に向けて、従来技術の改良、新規技術の開発など、さまざまなアプローチから研究されている。
産総研では、平成22~23年度に、所内プロジェクト「生活習慣病の早期診断のためのマルチマーカー計測システムの開発(プロジェクトリーダー 健康工学研究部門長 吉田 康一)」を実施し、国民医療費の30 %以上を占める糖尿病といった生活習慣病の予防や早期診断を目標とし、産総研内の各研究ユニットに分散していた技術を統合して、未病状態を診断するバイオマーカー群(マルチマーカー)の開発とともに、それらマルチマーカーを一度に迅速に計測・評価できるシステムの開発を行った。V溝バイオセンサーは、このプロジェクト内で発案・開発されたセンサー技術である。その後も電子光技術研究部門ではこの技術の改良を続け、V溝形状の最適化、表面修飾法の改良を行い、DNA検出や抗体を用いたインフルエンザウイルス検出にも成功した。
現在は、NEDOの委託事業「社会課題対応センサーシステム開発プロジェクト(〔4〕研究開発成果等の他分野での先導研究、平成25年度)」により、パナソニック株式会社、国立大学法人 神戸大学と共同で、本技術を用いた鳥インフルエンザウイルス監視システムの開発に向けた先導研究(フィージビリティースタディー)を実施中である。
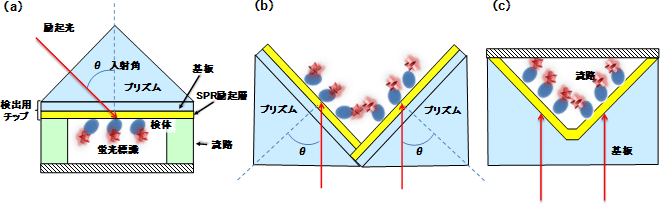
従来のSPRF検出系は光学プリズム上にSPR励起層を持つチップを密着させ、さらにこのチップ上に検体を保持する流路を接合した構成であった。また、励起用の光を、プリズムに対して所定の角度に調整して入射する必要があった(図1(a))。そのため使い勝手が悪く、装置が大型化するため、高感度であることが分かっていながら実用的な使われ方はされていなかった。そこで、図1(b)、(c)に示すように、底面に光が入射するプリズム面となるようなV字型の溝のマイクロ流路により流路そのものにプリズムの機能を持たせ、流路の内面にSPR励起層として金(Au)薄膜を持った構造を考案した。これによって、プリズム、検出用チップ、流路、と三つの部材に分かれていた構成を、一体化できた。また、センサーチップ底面に励起用の光を垂直に入射すればSPRが励起されるようにV溝の頂角を設定してあるので、煩雑な入射角の調整が不要で、下方から照射される励起光に対して水平にチップを置くだけでSPRF効果が得られる。
 |
|
図1 (a)従来のSPRF励起用の光学システム
プリズム底面に検出用チップを密着させ、検出チップ表面上に流路を接合して測定を行う。
(b)従来のプリズム部分を回転させて二つ組み合わせた、V溝バイオセンサー発案時の概念図
(c)今回開発したV溝バイオセンサーチップの断面図
|
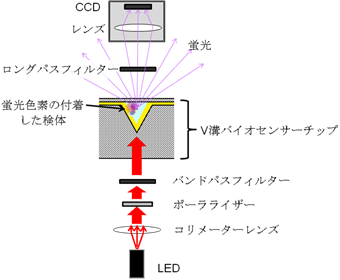
センサーシステム全体の構成を図2に示す。なお、ここでは光源にLEDを用いた場合を示している。コリメーターレンズにてLEDからの光を平行光にした後に、ポーラライザー(偏光子)でSPR励起に必要な向きの偏光にする。さらに、バンドパスフィルターで、単色光に近い光にした後に、V溝バイオセンサー底面に垂直に照射する。なお、光源としてレーザーダイオード(LD)も使用できる。LDからの光は、ほぼ単色で、しかも偏光なので、ポーラライザー、バンドパスフィルターは不要となる。V溝内面に形成したAu薄膜表面に励起光によってSPRが励起されるので、この面に蛍光色素で標識されたバイオ物質が吸着すると強い蛍光を発するため、高感度でバイオ物質を検出できる。センサーチップの材料にはポリスチレンを用いた。励起光波長、各種材料の屈折率や厚さなどからV溝頂角の最適値を算出したところ49°となった。なお、図2のロングパスフィルターは蛍光だけを透過させて励起光が直接CCDカメラに入ることを防ぐために設置している。
 |
|
図2 V溝バイオセンサーのシステム全体の構成図 |
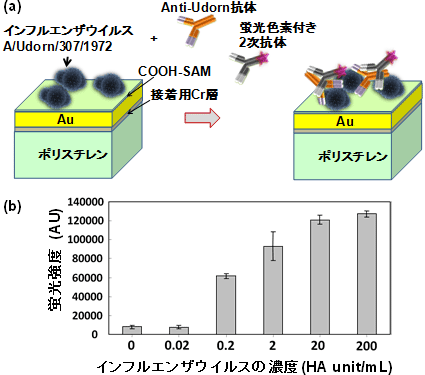
図3にインフルエンザウイルスの検出結果を示す。ここで用いたセンサーのV溝内面には厚さ0.6 nmのクロム(Cr)層を接着層とし、SPR励起層としてAu層を形成してある。Au層の上には、カルボキシル基(-COOH)の付いた自己組織化単分子膜(Self-assembled monolayer(SAM))を形成し、その上にA型インフルエンザウイルスの一種であるA/Udorn/307/1972ウイルスを固定化した。エタノールアミンでブロッキングを行った後、Anti-Udorn抗体を加え、その後、2次抗体として蛍光色素Alexa-Fluor-700にて標識された抗体を加えた。図3(b)はインフルエンザウイルスの濃度と蛍光強度の関係を示す。計測時間は2分とした。図に示すように0.2 HA unit/mLの濃度のウイルスがノイズレベルに対して有意に検出できている。なお、インフルエンザウイルス検出以外にも、DNA検出では1 nM(Mはmol/L)、ビオチン-ストレプトアビジン結合では100 fMの濃度での検出が可能であった。
 |
|
図3 (a)V溝バイオセンサーでインフルエンザウイルスの検出を行った際の、チップ表面での反応の模式図と(b)インフルエンザウイルスの濃度と観測された蛍光強度の関係 |
現時点では、V溝バイオセンサーによって得られる信号強度は、理論値の1 %以下に留まっている。これは主にV溝内面の緩やかな凹凸に原因があると考えている。センサーチップは金型成型によって作製しているが、金型はV溝に対応する三角形の凸形状を持つ。今回用いた金型には研磨時に残ってしまう数十 µmピッチで高さ数百 nm程度の「うねり」があり、これがV溝内面に反映される。このうねりのため、理論通りにSPRが励起されず、感度が低くなっていると考えられる。金型の精度を上げることで、1~2桁以上の高感度化が期待できる。
今回開発した技術を応用し、NEDOの委託事業として、パナソニック株式会社、国立大学法人 神戸大学と共同で、鳥インフルエンザウイルス監視システム用のV溝バイオセンサーシステムを試作した(図4)。平成22~23年度に実施した産総研内プロジェクトでの試作機(縦×横×奥行き、630×320×345 mm)と比べ、今回の試作機は260×180×160 mmと、体積比で約9分の1と大幅に小型化している。今回の試作機の蛍光検出部には冷却CCDを採用しているが、この部分をフォトダイオードなどで置き換えることができれば、さらなる小型軽量化が達成可能である。
 |
|
図4 NEDO委託事業にて平成25年11月に試作したV溝バイオセンサーシステム |
V溝バイオセンサーは、検出対象によっては既に100 fMオーダーの検出が可能であり、多くのバイオマーカー検出においては十分な感度を実現できているが、人に感染する前の環境中(例えば室内)に存在する極微量ウイルスを検出するには、現状よりさらに3桁程度の高感度化が必要であると試算される。今後は、センサーチップの製造プロセスを改良し、より理想的な形に近いV溝形状を実現し、さらにはV溝中に対象物質を濃縮させる技術も付与し、これらのニーズに応えられるような高感度化を目指す。また、現在は液体試料をピペットにて手動で注入しているが、小型ポンプを備えたマイクロ流路送液技術を融合させ、より簡便に検出できるシステムの構築も目指したい。2~3年以内の、実験室レベルの微量物質センサーシステムとしての製品化を目指す。さらにその数年後には臨床現場で使用できるシステムを目指したい。